母乳是婴儿早期的食物和营养来源,其含有乳糖和具有丰富营养价值的母乳低聚糖(Human milk oligosaccharides,HMO)。这些HMO包括2'-岩藻糖基乳糖(2'-Fucosyllactose,2'-FL;CAS:41263-94-9,分子量488.4g/mol)、3-岩藻糖基乳糖(3-Fucosyllactose,3-FL;CAS:41312-47-4,分子量488.4g/mol)、6'-唾液乳糖(6'-sialyllactose,6'-SL)和3'-唾液乳糖(3'-sialyllactose,3'-SL)等。含HMO的乳制品可为婴幼儿提供此类活性物质,促进健康成长。其中乳糖虽属于能量物质,但人体存在乳糖不耐受问题,因此含HMO的乳制品对乳糖含量有严格限制,例如2022年的12月1日正式生效的美国《食品化学法典》规定,2'-FL中乳糖含量不得高于8%。
HMO可采用提取法生产或采用动物乳制品替代,但包括牛乳在内的动物乳制品,HMO含量较低,无法满足营养需求。而从动物乳品中提取HMO的提取效率也较低。尽管有关于化学合成法制备HMO的报道,但HMO的化学合成仍然效率低下,其主要原因是HMO具有多个手性中心,为减少副产物,需要对多个羟基进行保护,从而使合成复杂化。因此,发酵法是目前生产HMO的主要工业生产方法。
关于发酵法制备HMO的改进是目前国内外研究的热点。其中改进方向主要有两个,一个方向是针对菌株的改进,即通过对菌株中涉及HMO合成和分泌相关的生物合成途径进行基因工程改造,提高HMO的合成和分泌;另一个方向是根据菌株的发酵生长过程,对工艺参数进行优化。前者的相关研究较多,如CN202011240682.5、CN202110823715.7、CN202211067625.0提供了几种工程大肠埃希氏菌提高了2'-FL、3-FL的产量。后者则主要根据发酵菌株不同生长阶段的目标产物合成和分泌特点及其对发酵培养条件的需求差异,人为延长目标产物合成和分泌的时间或量。例如,已知菌体生长的主要阶段包括延滞期(也称为调整期、延迟期、迟缓期或适应期)、指数期(也称为对数期)、减速期(如分批发酵培养可能存在明显的减速期)、稳定期(也称为平衡期、恒定期或最高生长期)、衰亡期。其中菌株生长曲线各阶段对碳源、温度、pH、溶氧的需求存在不同,目标产物合成和分泌主要在对数生长期至稳定期,放罐收获通常在衰亡期(农业出版社1992年出版,山西省原平农业学校主编《农业微生物学》第114-117页;中国医药科技出版社1999年出版,李榆梅主编《微生物学》第18-19页;中国农业出版社2001年出版,徐凤彩主编《酶工程》第57-58页;武汉理工大学出版社2011出版年,刘明华、全永亮主编《食品发酵与酿造技术》第80-82页)。因此,根据菌株在不同阶段对培养条件的需求差异(中国农业出版社2001年出版,徐凤彩主编《酶工程》第57-58页;中国医药科技出版社2005年出版,余伯阳主编《中药生物技术》第137-144页),通过动态调控温度、pH、溶氧或改变补料策略调控碳源浓度可在一定程度上提高目标产物产量。如,CN202110110430.9提供了一种分批补料的发酵策略,提高了2'-FL的产量。
然而,包括2'-FL和3-FL在内的HMO目前发酵生产水平仍然较低,尤其是3-FL的产量受诸多因素限制,面临瓶颈。
一种提高大肠埃希氏菌岩藻糖基乳糖产量的发酵生产方法,所述岩藻糖基乳糖为2'-岩藻糖基乳糖或3-岩藻糖基乳糖中的一种,所述发酵生产方法包括如下步骤:
大肠埃希氏菌选自大肠埃希氏菌K-12 MG1655、大肠埃希氏菌DE3、大肠埃希氏菌DSM33491中的一种。
S1绘制生长曲线:取大肠埃希氏菌接种至种子摇瓶液培养后,取种子摇瓶液转接入种子罐进行种子培养,种子培养后取种子罐培养液接种至发酵罐中进行发酵培养,监测发酵罐中菌群生长状态、碳源浓度、乳糖浓度,绘制菌群生长曲线,确定菌群生长的衰亡期;
S2发酵生产:按照步骤S1的发酵培养条件,在发酵罐中生产岩藻糖基乳糖,培养至衰亡期时,取步骤S1所述种子罐培养液再次接种至发酵罐,补加乳糖,再次发酵培养。其中乳糖是大肠埃希氏菌转化生成岩藻糖基乳糖的底物,而非碳源。因此,本领域公知,乳糖的补加可与再次接种同时进行,也可于再次接种后,间隔一定时间再补加乳糖。
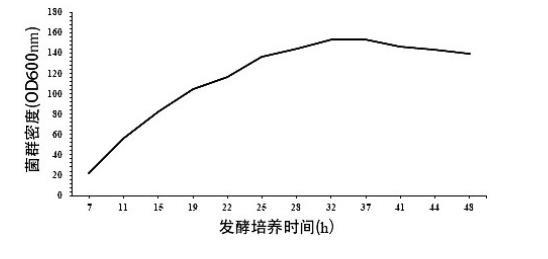
大肠埃希氏菌K-12 MG1655发酵生产3-岩藻糖基乳糖的菌群生长曲线
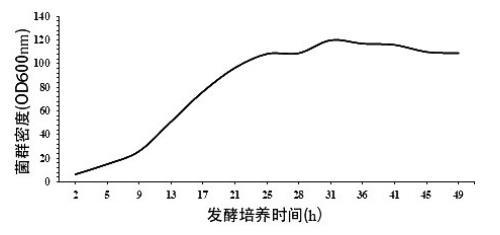
大肠埃希氏菌K-12 MG1655发酵生产2'-岩藻糖基乳糖的菌群生长曲线
通常认为,发酵过程中,菌群生长进入衰亡期后,由于培养液中营养物质失衡、底物限制、大量抑制性中间产物生成、pH和溶氧失衡等原因导致菌群死亡大于生成。虽然此时发酵罐中仍存在碳源等营养物质和底物,但目标产物合成趋于停滞,目标产物积累的增长幅度极小。因此发酵工艺中通常将菌群生长的衰亡期作为放罐收获期。目前通常在指数生长期、稳定期等阶段,进行补料发酵、pH调控、溶氧调控等尽可能推迟衰亡期,延长目标产物合成所在的稳定期等菌体生长和目标物分泌阶段。
但在考察大肠埃希氏菌发酵生产2'-岩藻糖基乳糖或3-岩藻糖基乳糖的菌群生长各阶段特征时,出乎预料地发现:发酵培养至菌群生长的衰退期后,虽然补加底物乳糖或补加培养基(即碳源)不能显著提高2'-岩藻糖基乳糖或3-岩藻糖基乳糖产量,但当补加一定量的菌种和底物乳糖后,仍可显著提高产2'-岩藻糖基乳糖和3-岩藻糖基乳糖的产量。推测其原因可能是,此过程中对菌种的生物合成途径中某种或某些相关酶造成了有利于促进目标物合成的突变或表达水平的转变。
显然,S2工艺中,衰亡期补加乳糖可以超量补加,也可仅按最低乳糖补加量进行补加。当不要求岩藻糖基乳糖产量达到同等条件最大值是(如同等再次接种接种量、同等发酵罐体积、同等发酵罐培养液体积、同等搅拌速度、同等温度、同等pH、同等溶氧量条件下),也可适当降低乳糖补加量,即低于所述“最低乳糖补加量”。换言之,此处所述“最低乳糖补加量”为S1工艺同等条件下,衰亡期再次接种的接种量相同、衰亡期乳糖补加量不同时,达到S2工艺的岩藻糖基乳糖产量最大值所需的最低的乳糖补加量。显然通过超量补加乳糖,可较快的获得该条件下S2工艺的岩藻糖基乳糖产量最大值。
根据乳糖转化率,采用如下常用公式,计算获得最低乳糖补加量:
LS2min=(FS2max-FS1)/T-LS1res;其中LS2min为S2工艺的衰亡期最低乳糖补加量,单位为g;LS1res为S2工艺再次接种前发酵罐培养液中剩余的乳糖量,单位为g;FS1为S1工艺的岩藻糖基乳糖产量,单位为g;FS2max为S1工艺同等条件下,衰亡期再次接种的接种量相同、衰亡期乳糖补加量不同时,S2工艺的岩藻糖基乳糖产量最大值,单位为g;T为S1工艺的乳糖转化率,T=岩藻糖基乳糖产量的g数/生成对应g数岩藻糖基乳糖所消耗的乳糖g数。
通过在菌群生长的衰亡期再次接种菌种和补加底物乳糖进行常规发酵培养,无需再次进行复杂的pH、溶氧等动态调控即可显著提高2'-岩藻糖基乳糖或3-岩藻糖基乳糖产量;为提高2'-岩藻糖基乳糖或3-岩藻糖基乳糖的工业发酵产量提供了新的工艺和方法。
