耐药性克雷伯氏菌属(Klebsiella)的细菌作为人类感染的重要病原,是临床治疗重要的挑战。本研究对多株克雷伯氏菌裂解性噬菌体的生物学特性和基因组特征进行比较分析,为其应用提供更多科学数据。
【方法】使用双层平板法从人类和动物新鲜粪便、污水中分离纯化裂解性克雷伯氏菌噬菌体;通过磷钨酸染色和透射电镜观察其形态;采用双层平板噬菌斑法确定其宿主范围,测定温度和pH稳定性、一步生长曲线和体外抑菌效果等生物学特性;基于全基因组测序对分离株进行比较基因组学分析;通过体内抑菌试验评估噬菌体对多重耐药变栖克雷伯氏菌(Klebsiella variicola) BS375-3感染的大蜡螟(Galleria mellonella)幼虫的保护作用。
1、材料与方法
1.1菌株来源分离
噬菌体所用宿主菌(1株K.variicola和3株K.pneumoniae)样品均采集自唐山市某医院,均由本实验室分离并置于–20℃甘油水冻存保藏。菌株信息NMDCX0000171存储在国家微生物科学数据中心(National Data Center for Microbial Sciences,NMDC)。
1.2噬菌体分离纯化
样本采集自唐山市某医院人类粪便、养猪场粪便和广州市西朗污水处理厂。对于粪便样品,将2 g置于15 mL离心管,补加无菌水至10 mL,充分混匀制成悬浊液,污水样品则取10 mL直接进行下步操作。样品8 000 r/min离心10 min,将上清液通过0.22μm水系微孔滤膜过滤至新的离心管内。将5 mL MH(B)培养基、1 mL上清滤液和100μL过夜培养的细菌培养物在另一15 mL离心管中混匀,35℃条件150 r/min连续培养12 h。培养液再次离心,上清液过滤后4℃保存备用。取100μL宿主菌液与8 mL预热的半固体培养基[40–50℃,MH(B)培养基+0.7%琼脂]混匀,倾倒于底层固体MH(A)平板,滴加10μL滤液,待液体干燥后倒置于35℃恒温箱中连续培养12 h,期间多次观察是否有透明噬菌斑出现。使用双层平板法对噬菌体进行纯化,挑取双层平板表面出现的单个噬菌斑,10倍梯度连续稀释,吸取适宜稀释度下100μL噬菌体液与等体积宿主菌液混匀,35℃条件下吸附10 min,加入8 mL预热的半固体培养基,颠倒混匀后倒入MH(A)平板,冷却凝固后35℃条件下倒置培养12 h。以上步骤重复3–5次,至噬菌斑形态、大小均一不再变化,即获得单一噬菌体。上述操作均在无菌条件下进行。
1.3一步生长曲线
将噬菌体与宿主菌以0.01的比例混合,于35 ℃孵育10 min吸附噬菌体。10 000 r/min离心1 min收集细菌,弃去上清,用新鲜MH(B)洗涤2次,之后重悬沉淀并添加MH(B)至5 mL,将离心管振荡混匀,计为0时刻,间隔10 min取样并经10 000 r/min离心1 min,取上层清液通过双层平板法测定效价,绘制一步生长曲线。
1.4体外抑菌实验
将对数生长期的菌株培养物,用MH(B)稀释,调OD595值为0.15,将稀释后的菌株培养物分装至4只无菌离心管内,每管10 mL,设置4个组,1个对照和3个实验组(表1)。对照组,离心管加入等体积MH(B)培养基;实验组1 [感染复数(multiplicity of infection, MOI)=10],10 mL菌株培养物加入等体积噬菌体液(以MOI为10的比例);实验组2 (MOI=1),10 mL菌株培养物加入等体积噬菌体液(以MOI为1的比例);实验组3 (MOI=0.1),10 mL菌株培养物加入等体积噬菌体液(以MOI为0.1的比例)。每组充分混匀后,分别分装至1.5 mL离心管,37 ℃、180 r/min培养,每3 h取样并测定595 nm处的吸光度,连续测定24 h,每组重复3次,绘制噬菌体体外抑菌曲线。
1.5噬菌体对大蜡螟幼虫的体内抑菌效果
重新复苏多重耐药变栖克雷伯氏菌BS375-3,进行活菌计数并调整其菌量为2×104、2×105、2×106 CFU。将体重为200–250 mg的大蜡螟(Galleria mellonella)幼虫随机分为3组,每组10只,饥饿处理24 h。使用70%的酒精对大蜡螟幼虫进行体表消毒,自尾部第一左足处注射K. variicola BS375-3菌液(20 μL/只,2×104、2×105、2×106 CFU),置于37 ℃黑暗培养箱,禁食处理,每隔4 h记录存活率,连续记录96 h。2×105 CFU感染的大蜡螟幼虫在96 h内死亡率为70%,被用于正式试验的感染菌量。将体重为200–250 mg的大蜡螟幼虫随机分为6组,每组10只,禁食处理24 h,使用70%医用酒精进行体表消毒。对于空白对照组及噬菌体处理组,首先自尾部第一左足处注射20 μL磷酸盐缓冲液(phosphate buffered solution, PBS),30 min后自对侧足部分别注射等量PBS和噬菌体pKV-BS375-3.1 (2×107 PFU);对于其余试验组,首先自尾部第一左足处注射20 μL K.variicola BS375-3菌液20 μL (2×105 CFU),30 min后在对侧足部分别注射等量的PBS、pKV-BS375-3.1 (2×107、2×106、2×105 PFU,表2)。将幼虫置于37 °C黑暗环境培养箱中,禁食处理,每隔4 h记录存活率,连续记录96 h。观察黑化情况和存活率。
2、结果
2.1噬菌体一步生长曲线
噬菌体一步生长曲线的测定发现,噬菌体pKP-BM327-1.2和pKP-M186-2.1潜伏期最长 (20 min),噬菌体pKP-BM327-1.2在第70分钟结束裂解期进入平台期,而噬菌体pKP-M186-2.1裂解期持续60 min进入平台期。噬菌体pKP-M186-2.2潜伏期小于10 min,在第60分钟进入平台期。噬菌体pKP-BS317-1.1潜伏期为10 min,在80 min时进入平台期;噬菌体pKV-BS375-3.1潜伏期小于10 min,该噬菌体在50 min时进入平台期。

图1 噬菌体的生物学特性
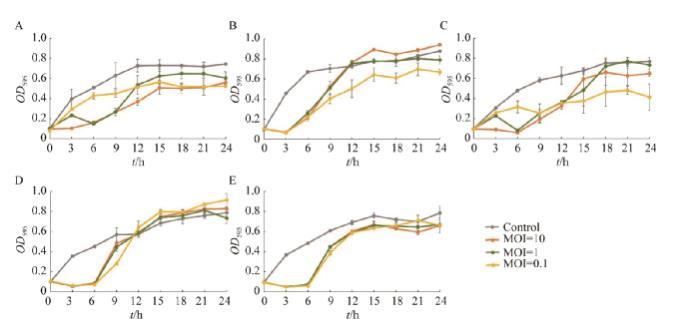
图2 噬菌体体外抑菌试验
2.2噬菌体体外抑菌效果
以未加噬菌体的细菌培养物作为对照,通过24 h内测定OD595评估5株噬菌体不同MOI (10、1、0.1)的体外抑菌效果。K. pneumoniae BM327-1培养物OD595在12 h内持续增加,以MOI为10的比例加入噬菌体pKP-BM327-1.2显示出最好的抑菌效果,3 h内完全抑制宿主菌株的生长(图2A);具有同一宿主菌(K. pneumoniae M186-2) 的噬菌体pKP-M186-2.1和pKP-M186-2.2表现出不同的体外抑菌效果:噬菌体pKP-M186-2.1可持续抑菌3 h,且与感染复数未表现出相关性(图2B),而以MOI为10的比例加入噬菌体pKP-M186-2.2后可以在6 h内完全抑制细菌增殖,以MOI为1和0.1添加噬菌体时,前3 h曲线呈上升趋势(图2C),表明低剂量的噬菌体pKP-M186-2.2抑菌效果较差;噬菌体pKP-BS317-1.1和pKV-BS375-3.1具有相似的体外抑菌效果,2株噬菌体均可持续抑制细菌达6 h (图2D、2E)。虽然5株噬菌体具有多样化的体外抑菌效果,但由于噬菌体抗性突变菌株的出现及增殖,体外抑菌曲线均会在3 h或6 h后呈现上升趋势。
2.3 噬菌体对大蜡螟幼虫的体内抑菌效果
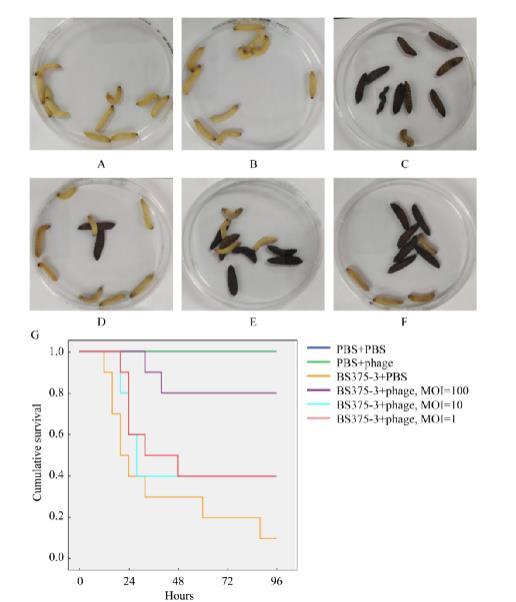
图3 噬菌体pKV-BS375-3.1对感染Klebsiella variicola BS375-3大蜡螟幼虫的保护效果
基于体外抑菌效果,选择噬菌体pKV-BS375-3.1进行大蜡螟幼虫体内抑菌试验。空白对照和噬菌体处理组未发现大蜡螟幼虫的黑化和死亡(图3A、3B)。大蜡螟幼虫感染组,在感染30 min后分别注射PBS和不同MOI比例的噬菌体。与空白对照组相比,感染但未经噬菌体处理组的大蜡螟幼虫在96 h内全部黑化,死亡率为90% (图3C)。感染后经MOI为100、10、1噬菌体处理组的大蜡螟幼虫96 h内死亡率分别为20%、60%和60% (图3D–3F)。Kaplan-Meier分析显示,感染后噬菌体处理组(MOI为100)大蜡螟幼虫96 h内存活率极显著高于感染对照组(K. variicola BS375-3+PBS)大蜡螟幼虫(P<0.001)。感染后噬菌体处理组(MOI为10和1)的大蜡螟幼虫在96 h内存活率均为40%,但与感染对照组(K. variicola BS375-3+PBS)不存在显著差异(P>0.05,图3G)。
结论
本研究中,不同噬菌体表现出不同的体外抑菌效果。整体来说,噬菌体在前3–6 h抑菌效果最好,随后出现噬菌体抗性菌。先前的研究表明,肺炎克雷伯氏菌噬菌体P24在1 h内裂解杀死108 CFU/mL宿主菌,并持续抑制细菌生长4 h ,与之相比,本研究中所分离噬菌体具有更长的抑菌时间。噬菌体抗性菌的出现是噬菌体疗法的重要挑战,但噬菌体抗性可能会导致细菌对抗生素耐药性的丧失。研究表明,K. pneumoniae 77与噬菌体KP36作用后,约半数突变株(14/31)的质粒丢失blaCTX-M、ant(3’’)、sul2、folA、mph(E)/mph(G)基因,从而恢复对抗生素的敏感性。另一研究发现,对万古霉素和达托霉素耐药的粪肠球菌由于Epa (胞外多糖生物合成基因)的突变而产生了对噬菌体的抗性,但对细胞壁和细胞膜靶向抗生素重新敏感。不仅如此,噬菌体抗性的出现还会导致细菌毒力的降低,例如,单核增生李斯特菌(Listeria monocytogenes)被证明获得噬菌体抗性后磷壁酸糖基化基因发生突变,这导致其在小鼠体内模型中毒力减弱,以及对Caco-2上皮细胞和HepG2肝细胞细胞系的入侵缺陷。因此,噬菌体鸡尾酒疗法或噬菌体与抗生素联合治疗对于预防和抑制噬菌体抗性菌的出现具有良好前景。
相关新闻推荐
1、肉豆蔻挥发油:枯草杆菌、大肠杆菌、黄曲霉等5种细菌生长曲线图绘制
