肿瘤免疫治疗是一种革命性的肿瘤治疗方法,利用人体自身的免疫系统识别和消灭癌细胞。近年来,随着对免疫系统机制理解的加深和生物技术的发展,肿瘤免疫治疗已成为恶性肿瘤治疗的一个重要手段,展现出巨大的治疗潜力和前景。肿瘤免疫治疗的概念可追溯至1891年,当时威廉·科利医生尝试使用细菌制品(后来称为“科利毒素”)治疗肿瘤,观察到某些癌症患者的肿瘤缩小,这是最早的尝试之一,其表明免疫系统能够对抗肿瘤。因此,威廉·科利被誉为免疫治疗之父。细菌免疫治疗另一个成功的案例是卡介苗(Bacillus Calmette-Guérin,BCG),它是一种减毒牛型结核分枝杆菌变异株,最初被设计为结核病疫苗,1990年被美国食品药品监督管理局(FDA)批准用于治疗膀胱癌。然而,由于科学技术限制和对免疫系统了解的不足,这一领域的进展较慢。
直到20世纪90年代末到21世纪初,随着分子生物学和免疫学的进步,研究者开始发现免疫检查点,这些是免疫系统上的"开关",能够调节免疫反应的强度。细胞毒T淋巴细胞相关蛋白-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)和程序性死亡-受体1(programmed death-1,PD-1)及细胞程序性死亡-配体1(programmed cell death-ligand 1,PD-L1)是最先被发现的重要免疫检查点。其发现不仅为理解免疫系统提供了重要见解,而且为开发新型抗肿瘤疗法奠定了基础。这些免疫检查点的抑制剂,如抗CTLA-4单克隆抗体伊匹利姆单抗(ipilimumab)和抗PD-1单克隆抗体纳武利尤单抗(nivolumab),成为了第一代免疫检查点抑制剂,显示出其在多种肿瘤治疗中的有效性。除了免疫检查点抑制剂外,另一个重要的进展是嵌合抗原受体T细胞(chimeric antigen receptor T-cell immunotherapy,CAR-T)疗法的开发。这种方法涉及将患者的T细胞从体内分离出来,通过基因工程方法赋予它们特定的抗体,这些抗体能够识别并攻击癌细胞,然后将这些被"武装"过的T细胞重新输回患者体内。
CAR-T疗法在某些类型的血液癌症中取得了显著成功,开辟了免疫治疗的新领域。肿瘤免疫治疗的未来方向包括但不限于:进一步优化免疫检查点抑制剂,开发针对其他免疫检查点的治疗药物;结合传统治疗方法(如化疗、放疗)和免疫治疗,以实现协同效应以及个性化免疫疗法的开发,根据患者的免疫状态和肿瘤特性定制治疗方案。
瘤内微生物对肿瘤免疫治疗
影响瘤内微生物群作为肿瘤微环境中的重要组成部分,对肿瘤免疫治疗的影响受到了广泛关注。瘤内微生物,包括细菌、病毒、真菌等,已被证实能够通过多种机制影响肿瘤的免疫反应和治疗效果。瘤内微生物不仅能够直接作用于肿瘤细胞,促进或抑制其生长,还能通过影响肿瘤微环境中的免疫细胞来间接调控肿瘤的免疫逃逸机制。
近期的一些研究发现瘤内微生物群也会影响肿瘤的免疫治疗。如Bender等益生菌罗伊氏乳杆菌(limosilactobacillus reuteri,Lr)易位到黑色素瘤、定植并持续存在于黑色素瘤内,通过其释放的膳食色氨酸分解代谢物I3A,其局部促进产生干扰素γ的CD8+T细胞,从而增强免疫检查点抑制剂(immune checkpoint inhibitors,ICI)。这说明瘤内菌群对肿瘤免疫治疗具有促进作用。Gao等发现在PD-L1阻断治疗期间,结直肠肿瘤组织中的核镰刀菌通过激活STING信号诱导PD-L1表达,并增加干扰素-γ(IFN-γ)CD8肿瘤浸润淋巴细胞(TIL)的积累,从而增强了PD-L1阻断对小鼠CRC的抗肿瘤作用,并延长了小鼠生存期。同样,Sivan等发现共生双歧杆菌可以通过增强树突状细胞功能来引发CD8+T细胞并在肿瘤微环境中积累,从而促进抗肿瘤免疫和抗PD-L1功效。
此外,Yang等发现双歧杆菌全身给药后在肿瘤内积累,双歧杆菌通过在肿瘤微环中积累的能力促进了肿瘤组织上的局部抗CD47免疫治疗,并通过激活干扰素基因刺激物和干扰素相关途径,增加对抗CD47治疗后树突状细胞的交叉启动,进一步加强了免疫治疗的效果。Shi等发现脆弱芽孢杆菌通过激活特定的免疫应答和促进树突状细胞的成熟,可以增强一种免疫检查点抑制剂(CTLA-4阻断剂)在治疗纤维肉瘤的效果。同时Vétizou等发现在小鼠和患者中,对多形拟杆菌或脆弱拟杆菌的特异性T细胞反应与CTLA-4阻断的功效相关,抗生素治疗或无菌小鼠的肿瘤对CTLA阻断无反应,通过给与双歧杆菌或脆弱拟杆菌来克服这一缺陷,其结果明显改善,揭示了拟杆菌在CTLA-4阻断的免疫刺激作用中发挥关键作用。
然而,另一方面研究也发现某些瘤内微生物能促进免疫逃逸,导致对免疫治疗的耐药性,其可能通过直接干预免疫检查点路径或改变药物的代谢,减弱治疗药物的效能,从而对免疫治疗产生抵抗。这种耐药性的形成复杂多样,既包括微生物自身特性的变化,也涉及宿主免疫系统的调节异常。因此,瘤内微生物的研究为克服癌症免疫治疗中的耐药问题提供了新的视角和策略,如通过调整患者的微生物组成或利用特定微生物或其代谢产物来优化免疫治疗的效果。这一领域的进一步研究将有助于深化对癌症治疗机制的理解,并开发出更有效的治疗方法。总之,尽管各种研究表明肿瘤内微生物群与免疫治疗效果之间的关系,但潜在的机制仍待进一步研究。深入地研究肿瘤内微生物群对免疫治疗疗效的影响,将为癌症的临床治疗提供新的方向。
5、靶向瘤内微生物改善免疫治疗
耐药在过去几十年里,化疗和免疫疗法一直是癌症治疗的主要手段。然而,肿瘤逐渐对化疗药物产生耐药性,同时一些接受免疫治疗的患者表现出治疗效果不佳,并且显示出耐药性主要是因为缺乏精确度和敏感性。随着基因编辑技术、合成生物学等新生物技术的不断发展,新型肿瘤治疗方法已经成为可能,并且可以与免疫治疗联合应用,进一步增强其抗肿瘤治疗效果(图1),本图由Figdraw绘制。
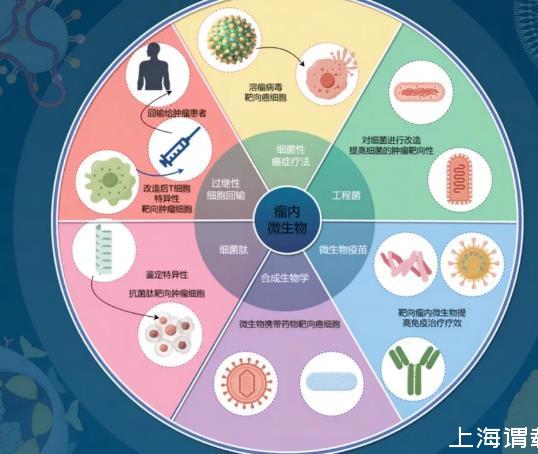
细菌在肿瘤部位的趋化定植及其免疫原性为微生物在肿瘤治疗中的应用提供了理论基础。肿瘤组织中的血管缺陷、酸性、低氧环境和营养物质匮乏吸引细菌定植于肿瘤组织中。Raman等在荷瘤小鼠中静脉注射鼠伤寒沙门菌,使用荧光技术准确测量这种细胞渗透,研究发现,70%的沙门氏菌能侵入癌细胞内部;相反,传统化疗药物在治疗肿瘤时由于难以进入肿瘤内部的坏死区域而导致治疗效果不佳。因此,细菌不仅能够靶向肿瘤内部还能够在肿瘤核心定植,这是其他类型药物难以靶向定值的区域。对细菌进行不同的修饰和改造,可以进一步提高肿瘤的靶向性、治疗效果和安全性。
Liu等发现,核梭杆菌(Fusobacterium nucleatum,F.nucleatum)已被发现定植于三阴性乳腺癌(triple-negative breast cancer,TNBC)中,利用这一发现构建了一种纳米平台,利用细菌来源的外膜囊泡(outer membrane vesicles,OMV)来精准靶向肿瘤组织,这个平台可以同时对核镰刀菌和癌细胞进行双重杀伤,从而将肿瘤内细菌转化为TNBC免疫治疗中的免疫增强剂。最大限度地发挥抗肿瘤免疫反应,实现了TNBC的高效治疗和转移预防。Zheng等观察到,经过工程处理的沙门氏菌在肿瘤微环境(tumor microenvironment,TME)中的定植,通过TLR4信号传导途径,促进了免疫细胞(如单核细胞/巨噬细胞和中性粒细胞)的丰富浸润。这些定植于肿瘤内的沙门氏菌释放出创伤弧菌鞭毛蛋白B(flaB),并减少M2型巨噬细胞的抑制活性,从而降低了肿瘤内巨噬细胞的M2表型。这一过程激活了具有M1表型的肿瘤巨噬细胞的功能,增强了免疫治疗的效果。Canale等发现工程益生菌大肠杆菌Nissle 1917菌株,该菌株可在肿瘤中定植并不断转化氨,氨是一种积聚在肿瘤中的代谢废物6,到L-精氨酸。肿瘤与这些细菌的定植增加了肿瘤内L-精氨酸浓度,增加了肿瘤浸润T细胞的数量,并且在肿瘤清除方面与PD-L1阻断抗体具有显著的协同作用。这表明工程微生物疗法能够对肿瘤微环境进行代谢调节,从而提高免疫疗法的疗效。
尽管微生物治疗方法在临床试验和动物实验取得了一些积极的结果,但微生物治疗方法的临床转化仍然面临许多挑战。缺乏充足的证据限制了微生物治疗方法的广泛应用。微生物在肿瘤治疗中的最终效果主要取决于这些微生物对肿瘤内部和全身免疫系统的功能影响。因此,微生物在肿瘤治疗中的作用机制是至关重要的,有望为开发更有效的治疗策略提供新的思路和途径。
结语与展望
瘤内微生物与免疫治疗的研究是近年来肿瘤治疗领域的一个热点。微生物群在癌症的发生、发展及治疗中发挥作用,尤其是在免疫治疗的效果上。免疫检查点抑制剂,已经成为许多肿瘤治疗的重要组成部分。瘤内微生物通过影响肿瘤免疫微环境来影响肿瘤治疗疗效。因此基于患者特定的瘤内微生物组成,可开发个性化的微生物干预策略,以优化免疫治疗的效果;探索微生物干预与传统免疫治疗药物的联合应用,以实现更加有效的肿瘤治疗仍然是未来研究的重点方向。
相关新闻推荐
1、揭示肠道微生物群与克罗恩病(CD)之间的联系及独特作用机制
