鬼臼毒素(Podophyllotoxin)(图1)又名鬼臼素、鬼臼毒,是一种具抗肿瘤活性的先导化合物,属于木脂素类,主要从鬼臼类植物(桃儿七、八角莲、山荷叶)中分离得到。鬼臼毒素通过破坏有丝分裂细胞中的微管蛋白集结及微管的形成,使细胞有丝分裂停止在M期,抑制肿瘤细胞分裂,发挥抗肿瘤作用。瑞士Sandoz公司首先合成了鬼臼毒素的C-4位糖苷化衍生物依托泊苷(Etoposide)和替尼泊苷(Teniposide),用于治疗肺癌、淋巴癌、白血病、睾丸癌等。但鬼臼毒素具有强烈的毒副作用,如:导致贫血、脱发、胃肠道功能紊乱、骨髓抑制等,限制了其临床使用,因此其分子结构有进一步修饰的必要。
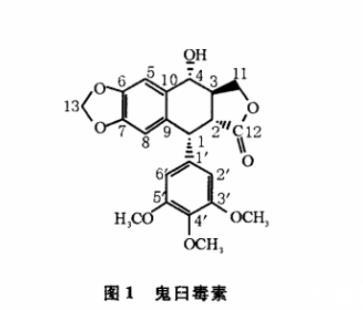
图1鬼臼毒素
为获得结构新颖的鬼臼毒素类活性物质,探索它们的构效关系,一条途径是用化学合成方法改造其结构,另一条途径是微生物转化。微生物转化具有区域和立体选择性强、反应条件温和、操作简单、成本低廉等优点,还能完成一些化学方法难以实现的反应,常被用于天然产物的化学修饰,以获得一些结构更合理或活性更好的类似物或衍生物。国内外学者对鬼臼毒素的微生物转化作了一些探索,北京大学果德安教授利用青霉菌和掌叶大黄细胞转化鬼臼毒素,使鬼臼毒素D环的反式结构转化为顺式,得到无活性的鬼臼苦素。英国诺丁汉大学Broomhead等发现美国金钟连翘悬浮培养细胞具有将鬼臼毒素氧化为鬼臼毒酮的能力。澳大利亚墨尔本大学Teng等利用大麦悬浮培养细胞转化鬼臼毒素,得到异鬼臼苦酮。本研究从桃儿七根茎中分离出能转化鬼臼毒素的内生放线菌,用其转化鬼臼毒素,获得了1种转化产物,经结构分析初步确定为4'-去甲基表鬼臼毒素,菌种鉴定为Streptomyces sp.,为进一步研究内生菌与鬼臼毒素的微生物转化的机理和开发利用鬼臼毒素类活性物质奠定了基础。
1材料与方法
1.1材料
1.1.1样品采集
2010年4月中旬,于成都植物园采集桃儿七根茎样品,样品经1 d左右自然风干后进行内生放线菌的分离。
1.1.2培养基分离
培养基(ISP2):酵母粉4 g,麦芽提取物10 g,葡萄糖4 g,琼脂15 g,蒸馏水1 L,pH 7.3,121℃灭菌20 min;种子培养基/转化培养基:葡萄糖10 g,蛋白胨5 g,酵母粉5 g,玉米浆5 g,牛肉膏3 g,FeCl30.05 g,KH2PO40.5 g,NaCl 0.5 g,MgSO40.5 g,蒸馏水1 L,pH 7.0,121℃灭菌20 min。
1.1.3试剂
鬼臼毒素购自西安杨森制药有限公司,纯度98%;PCR试剂购自北京天根生化科技有限公司;PCR回收试剂盒、合成引物购自上海生工生物工程技术服务有限公司;序列测定于英俊生物科技有限公司。
1.1.4仪器岛津LC-20A高效液相色谱仪;Varian Mercury-300BB型核磁共振仪;Agilent MSD Trap离子阱质谱仪。
1.2方法
1.2.1桃儿七根茎内生放线菌的分离
材料预处理采用75%乙醇擦拭表面及切口,并于火焰上快速烤干,风干保存1 d左右后处理进行内生放线菌的分离,如近期不分离的材料则置于4℃保存。表面消毒采用Coombs等方法,使用无菌刀将消毒后的茎部组织切成1 cm2左右的小片,贴在分离培养基表面,留下最后一遍无菌水清洗液做涂布对照,用来检测表面消毒效果。接种后于28℃培养间培养3~5周。约3~4周后,大多数内生放线菌长出,无菌操作条件下用接种针挑取放线菌到ISP2平板划线,纯化后的菌株转接到ISP2斜面活化培养。
1.2.2鬼臼毒素转化菌株的筛选
将分离的内生放线菌接种至装有50 mL种子培养基的摇瓶(250 mL)中,28℃振荡培养3 d,然后以10%的接种量接入转化培养基中,发酵3 d,然后在摇瓶中加入用乙醇溶解的鬼臼毒素30 mg,继续培养。每间隔1 d取10 mL包含菌丝体的发酵液,用匀浆器捣碎,利用等量的乙酸乙酯萃取,通过旋转蒸发浓缩萃取液,用TLC和高效液相色谱(HPLC)对样品进行检测,筛选能对鬼臼毒素进行生物转化的内生菌株。TLC条件:展开剂为氯仿-丙酮(5∶1),254 nm紫外显色;HPLC条件:色谱柱为C18(4.6 mm×250 mm,5μm),流动相乙腈∶水=40∶60,流速1.0 mL/min,紫外检测波长230 nm。
1.2.3生物转化产物的分离和结构鉴定
按上述方法对筛选获得的内生放线菌发酵,收集10 L发酵液,离心分离菌丝体并用匀浆器捣碎,而后与上清液合并,用乙酸乙酯萃取3次,合并萃取液,旋转蒸发浓缩,浓缩部分(5.2 g)经过硅胶柱层析(流动相氯仿-丙酮梯度洗脱)分离,获得相关组分A(50 mg),然后用制备HPLC(流动相乙腈∶水=50∶50)纯化,得到转化产物A(15 mg),然后对其做质谱和核磁进行结构鉴定。
1.2.4内生放线菌的鉴定
①菌丝形态观察:通过扫描电镜观察菌丝的形态,在ISP2平板上挖1 cm宽的长方形小穴,在穴的边缘接种,然后盖上无菌盖玻片,培养10~14 d,取出盖玻片喷金,进行扫描电镜观察;②菌落培养特征:选取9种培养基,在28℃培养菌株,观察并记录第4、7和14天菌落形态以及色素的有无和颜色等。9种培养基包括ISP2培养基、ISP3培养基、ISP4培养基、LB培养基、蔗糖察氏培养基、TSB培养基、葡萄糖酵母琼脂培养基、PDA培养基、高氏一号培养基;③生理生化特性:实验方法:对菌株的生长条件(温度、pH)、NaCl耐受性、C源利用、N源利用、酯酶分解、淀粉水解、明胶液化、牛奶凝固及冻化、纤维素分解、硝酸盐还原、MR实验、色氨酸分解、H2S产生、氧化酶和过氧化氢酶产生等生理生化指标进行了考察;④16S rRNA基因的PCR扩增及测序:采用酶解法提取菌丝体的DNA,选用通用引物PA8:5'-CCGTCGACGAGCT CAGAGTTTGATCCTGGCTCAG-3',PB1:5'-CCCGGGTACCAAGCTTAAGGAGGTGATCCAGCCGCA-3',扩增16S rRNA基因序列。利用上海生工生物工程公司SanPrep DNA胶回收试剂盒对扩增产物进行回收,然后送样、测序;⑤系统发育分析:将菌株的16S rRNA基因序列在NCBI上BLAST比对,再用Eztaxon数据库对序列进行在线分析,把相近模式菌种的序列放在一起做比对,序列比对采用Bioedit和Clustal X软件,然后用Mega 4.0软件构建NJ系统发育树。并将测得序列提交GenBank注册,获得登录号。
相关新闻推荐
1、新型广谱阴沟肠杆菌噬菌体ZX14的分离鉴定、生长曲线、体体外杀菌活性实验(四)
