2结果与分析
2.1鼠李糖乳杆菌Probio-M9连续培养100代过程中表型研究
2.1.1绘制生长曲线
不同的生长周期,菌种的生理状态有所差异,因此,菌种的传代通常选择对数生长期末期或者稳定期初期为宜,以1%的接种量,将原始菌株接种于液体MRS培养基中,37℃恒温培养24 h过程中OD600nm值变化情况如图1所示。
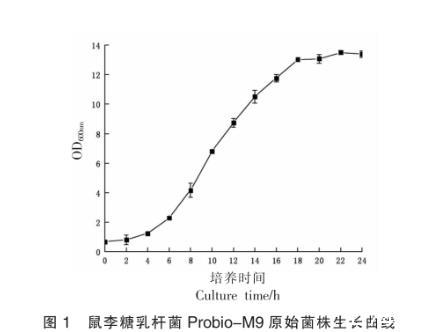
图1鼠李糖乳杆菌Probio-M9原始菌株生长曲线
由图1可知鼠李糖乳杆菌Probio-M9在37℃恒温培养24 h过程中OD600nm值的变化趋势,0~2 h鼠李糖乳杆菌Probio-M9处于延滞期,2~20 h处于对数生长期,20 h后进入稳定期,这与Liu等对鼠李糖乳杆菌Probio-M9生长特性研究结果基本一致。活菌数变化趋势与OD600nm值总体相似,初始接入活菌数为(1.37±1.40)×106CFU/mL,对数生长期(2~20 h)活菌数增加至(1.64±0.71)×108CFU/mL,且此后随着时间推移活菌数不再增加。如图1所示,20~24 h时虽OD600nm值略有增加,但活菌数基本维持不变,表明在20~24 h期间鼠李糖乳杆菌Probio-M9生长已处于稳定期。参照1.2.1.3节菌株生长代时计算方法,到达稳定期鼠李糖乳杆菌Probio-M9的生长代数约为6.90代,且一直培养到24 h仍处于稳定期,同时考虑到便于连续传代操作,故选择每个培养周期为(24±0.50)h作为传代周期。
2.1.2菌株连续传代过程中的菌体形态观察
对鼠李糖乳杆菌Probio-M9 A0、A25、A50、A75和A100菌悬液进行革兰氏染色并在显微镜下观察菌体形态,发现鼠李糖乳杆菌Probio-M9连续传100代菌体形态均属于鼠李糖乳酪杆菌典型形态,且在连续传代过程中,各代时的菌体形态无明显差异。
2.1.3菌株连续传代过程中碳水化合物利用能力
本试验对连续传代培养的鼠李糖乳杆菌Probio-M9的碳水化合物代谢能力进行了分析。原始菌株及连续培养传代过程中(0,25,50,75,100代)的菌株对49种不同碳水化合物的代谢能力进行检测,结果见表2。
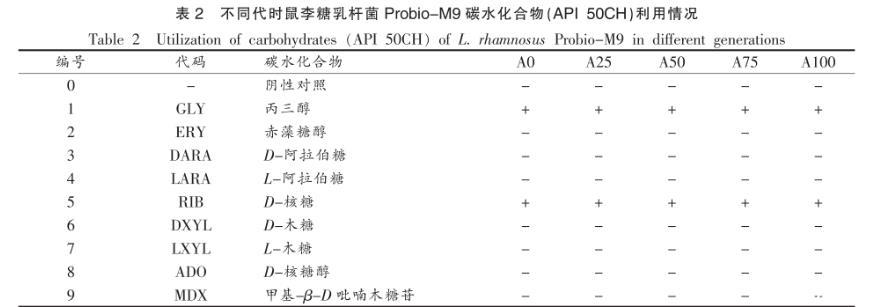
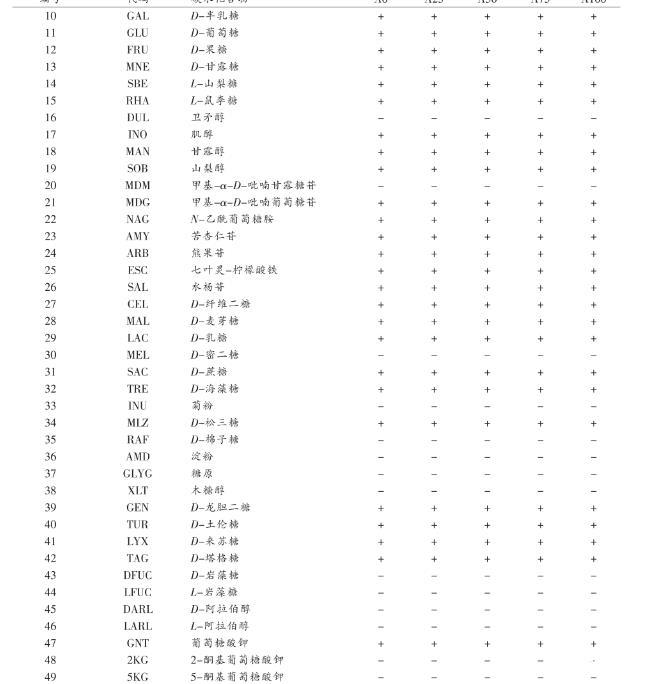
表2不同代时鼠李糖乳杆菌Probio-M9碳水化合物(API 50CH)利用情况
由表2可知,鼠李糖乳杆菌Probio-M9可利用28种碳水化合物:丙三醇、D-核糖、D-半乳糖、D-葡萄糖、D-果糖、D-甘露糖、L-山梨糖、L-鼠李糖、肌醇、甘露醇、山梨醇、甲基-α-D-吡喃葡萄糖苷、N-乙酰葡萄糖胺、苦杏仁苷、熊果苷、七叶灵-柠檬酸铁、水杨苷、D-纤维二糖、D-麦芽糖、D-乳糖、D-蔗糖、D-海藻糖、D-松三糖、D-龙胆二糖、D-土伦糖、D-来苏糖、D-塔格糖和葡萄糖酸钾。鼠李糖乳杆菌Probio-M9在连续培养100代过程中,5个不同代时(A0/A25/A50/A75/A100代)的碳水化合物利用能力无变化,说明鼠李糖乳杆菌Probio-M9连续培养100代对其碳水化合物的代谢能力没有影响,菌株在此连续培养传代过程中稳定。
2.1.4菌株传代过程靶向代谢物分析
本研究对鼠李糖乳杆菌Probio-M9在连续传代过程中,各代时(0/25/50/75/100代)菌株有机酸及短链脂肪酸代谢物进行分析,结果表明如图3所示,各代时(0/25/50/75/100代)在苯乳酸(Phenyllactic acid)、柠檬酸(Citric acid)、酒石酸(Tartaric acid)苹果酸(malic Acid)、琥珀酸(Succinic acid)、4-羟基苯乳酸(4-Hydroxyphenyllactic acid)、苯甲酸(Benzoic acid)、草酸(Oxalate)、水杨酸(Salicylic acid)、苯丙酸(Propionic acid)、乳酸(Lactic acid)、丙酸(Propionic acid)、丁酸(Butyrate)、己酸(Hexanoic acid)、乙酸(Acetic acid)等代谢物质之间无明显差异。
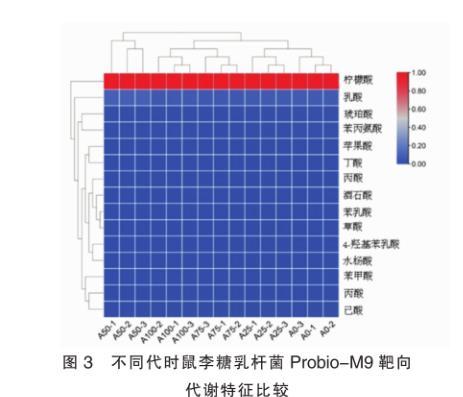
图3不同代时鼠李糖乳杆菌Probio-M9靶向代谢特征比较
相关新闻推荐
2、桑椹菌核病拮抗菌的分离筛选、鉴定、生防作用与机理——讨论与结论
3、转录组技术分析产紫篮状菌抑制尖镰孢菌生长的作用机制——讨论与结论
