1.2.6噬菌体裂解谱的测定
取100μL噬菌体原液以1∶1分别与被调查的45株鸡大肠埃希氏菌菌悬液吸附反应15 min,双层琼脂法过夜培养,观察结果。
1.2.7噬菌体最佳感染复数
(multiplicity of infection,MOI)的测定将宿主菌培养至OD600≈0.5(对数生长期),以固定的对数宿主菌液(100μL),按照感染复数分别为0.000 000 1、0.000 001、0.000 01、0.000 1、0.001、0.01、0.1、1的比例加入相应体积的噬菌体液并混匀,静置吸附15 min,均补加LB液体培养基至2 mL,振荡培养4 h。10 000 r/min离心10 min,取上清,10倍倍比稀释后,与培养至对数期的菌液混合吸附,用双层琼脂法测定上述比例培养液的噬菌体滴度,滴度最高者即为最佳MOI。
1.2.8噬菌体一步生长曲线的测定
将培养至对数期的菌液(100 ml)与噬菌体液按MOI=0.001混匀,并在静置吸附20 min后补加LB至200 mL,此为时间0,37℃、160 r/min,在0 min、5 min、10 min、15 min、20 min、25 min、30 min、40 min、50 min、60 min、70 min、80 min、90 min、110 min、130 min、150 min、170 min、190 min、210 min,19个时间点各取2 mL,离心、稀释、吸附,做3次重复试验,每次2个平行,采用双层琼脂法测定噬菌体滴度,并根据滴度绘制噬菌体感染宿主菌的一步生长曲线。
1.2.9噬菌体pH敏感性的测定
取100μL噬菌体液分别接种于900μL不同pH(pH2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0)的LB液中,37℃水浴孵育2 h,稀释、吸附,用双层琼脂法测定噬菌体滴度。观察噬菌体的生长情况,绘制曲线。
1.2.10噬菌体耐热稳定性的测定
分别取300μL效价为5.5×109PFU/mL的噬菌体原液于若干灭菌离心管中,将之分别置于40、50、60、70、80℃条件下处理,在0 min、20 min、40 min、60 min、80 min、100 min、120 min、140 min、160 min、180 min,10个时间点取样并迅速放置于4℃,稀释、吸附、倒板,测定其不同温度下、不同时间点噬菌体的滴度,绘制热稳定性曲线。
2结果
2.1噬菌体的分离与纯化
本试验以45株鸡大肠埃希氏菌与污水水样共培养,采用双层琼脂平板法经5次反复纯化,在平板上生长的噬菌斑形态、大小均单一,得到1株裂解性噬菌体,其噬菌斑形态和大小见图1,噬菌斑呈透亮的圆形,直径0.8 mm~1.1 mm,边缘整齐无晕环,将此噬菌体命名为vB-EcoM-IME540。
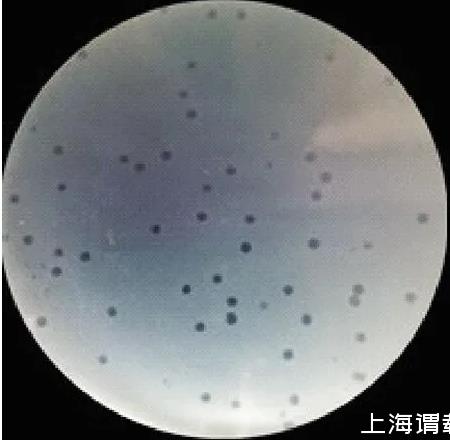
图1噬菌体vB-EcoM-IME540的噬菌斑形态
2.2噬菌体的电镜形态
透射电镜观察结果,如图2所示,噬菌体vB-EcoM-IME540的头部呈椭圆形且尾部具有收缩性,头尾被颈圈分开,头大小约106.7 nm×73.3 nm,尾长约140 nm×16.7 nm。根据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)在2011年发布的第9次报告中噬菌体的分类与命名标准,噬菌体vB-EcoM-IME540属有尾噬菌体目(Caudovirales),肌尾噬菌体科(Myoviridae)。
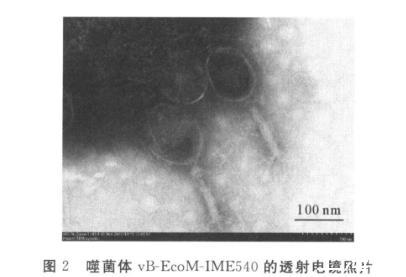
图2噬菌体vB-EcoM-IME540的透射电镜照片
2.3噬菌体的核酸类型鉴定
噬菌体核酸琼脂凝胶电泳结果,如图3所示,噬菌体vB-EcoM-IME540的核酸只能被DNaseⅠ消化,却不能被RNase A与Mung Bean Nuclease消化,表明该噬菌体核酸为双链DNA(Double-stranded DNA,dsDNA)。
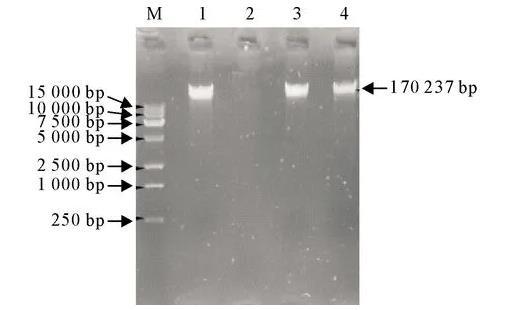
M.DNA标准DL 15 000;1.vB_EcoM-IME540核酸;2.DNaseⅠ;3.RNase A;4.Mung Bean Nuclease
相关新闻推荐
1、基于生长曲线分析存活菌株判断细菌和链霉菌对紫外线的耐受性能
