1.2.4实时定量PCR
收集对数生长期的RAW264.7细胞,铺板密度为1.0×105个细胞/孔,接种于六孔培养板内,设置空白对照组、阳性对照组(浓度为1µg·mL−1的LPS)、人参外泌体给药组(5、10、20µg·mL−1),培养24 h,弃去原有培养基,按照分组给药,培养24 h后收集细胞,用Trizol提取总mRNA,根据反转录试剂盒说明合成cDNA。使用实时定量PCR检测IL-6、iNOS、TNF-α、MCP-1转录水平的含量。实时定量PCR扩增反应条件是94℃,30 min,1个循环;94℃,30 s,55℃,30 s,40个循环;95℃,1 min,72℃,10 min,1个循环,PCR引物序列如表1。
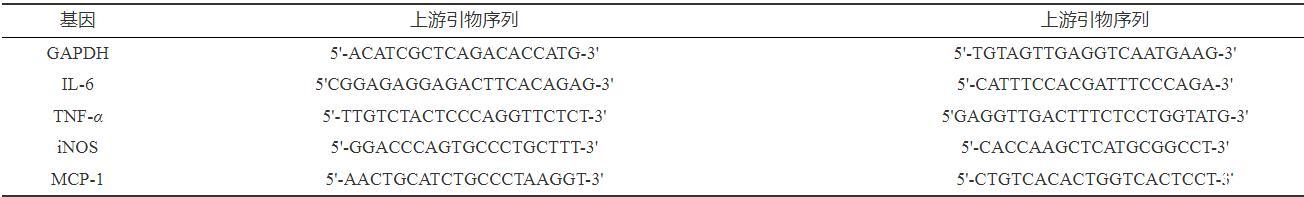
表1实时定量PCR引物序列
以GAPDH为内参,根据2−ΔΔCt的方法确定转录水平变化。
1.2.5流式细胞术检测人参外泌体对RAW264.7细胞极化的影响
RAW264.7细胞按照1.2.4培养,吸出原有的培养基,1000×g离心5 min收集细胞,PBS重悬,加入3µL FITC anti-mouse CD80 antibody,4℃避光孵育30 min,1000×g离心5 min,弃去上清,PBS洗涤一次,1000×g离心5 min,弃去上清,300µL重悬细胞,流式细胞术检测M1型巨噬细胞标志CD80的表达。
1.2.6 A549细胞活力测定实验
A549细胞按照密度3.0×104个细胞/孔铺板,培养24 h,吸出原有的培养基,加入相应的条件培养基,培养24 h,按照比例加入CCK-8溶液,在细胞培养箱孵育30 min,在450 nm处测定吸光度并计算。细胞存活率计算公式如下:
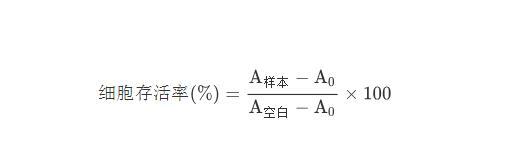
式中;A0为空白组的OD值;A样本为实验组的OD值;A空白为对照组OD值。
1.2.7 A549细胞周期实验
A549细胞按6.0×104个细胞/孔接种于六孔培养板内,培养24 h,弃去原有培养基,加入相应的条件培养基,培养24 h后,室温条件下,1000×g左右离心5 min,收集细胞,取细胞沉淀,按照细胞周期检测试剂盒说明书对细胞进行染色处理,利用流式细胞仪检测A549细胞周期的变化,运用分析软件FlowJo 7.6分析细胞周期变化。
1.2.8 A549细胞凋亡实验
细胞培养方法如1.2.7,使用胰酶消化,收集细胞到离心管中,1000 r/min离心5 min后弃去上清,加入400μL Annexin V-FITC结合液轻轻重悬细胞,加入5μL Annexin V-FITC和10μL碘化丙啶染色液,混匀,37℃避光孵育20 min,用流式细胞分析仪检测人参外泌体刺激巨噬细胞极化对A549细胞凋亡的影响。
1.2.9免疫印迹
细胞培养方法如1.2.7,收集细胞到离心管内,1000×g离心5 min,吸除上清,加入适量RIPA裂解液,充分裂解细胞。使用BCA蛋白测定试剂盒测定蛋白浓度并调整至相同浓度,利用十二烷基磺酸钠-聚丙稀酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)分离,恒流220 mA转膜90 min、使用5%PBS奶粉封闭1 h后,使用TLR4、MyD88、NF-κB、iNOS、COX-2一抗孵育过夜,回收一抗,PBST洗涤3次,二抗室温孵育1 h,PBST洗涤3次,使用iBright智能成像系统显色并观察条带,用Image J软件进行分析。
1.3数据处理
实验数据采用GraphPad Prism 8.0软件进行统计学分析,数据资料采用均值±标准差(X±SD)表示,组间数据采用单因素方差分析,P<0.05表示显著性差异。
2.结果与分析
2.1人参外泌体对RAW264.7的细胞活力的影响
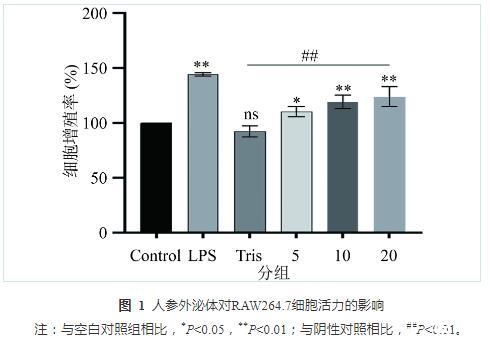
RAW264.7经Tris-HCl、LPS以及不同浓度的人参外泌体处理24 h,与空白对照组相比,阴性对照组(Tris-HCl)对RAW264.7细胞没有增殖作用;在阳性对照组(LPS)浓度为1µg·mL−1时,细胞活力显著增强(P<0.01);与空白对照组相比,随着GDNPs浓度的增加,细胞活力在浓度为5~20μg·mL−1范围内显著增强,具有明显的浓度依赖性,人参外泌体浓度为20μg·mL−1时RAW264.7的细胞活力最强(P<0.01),其次是人参外泌体浓度为10μg·mL−1(P<0.01),浓度为5μg·mL−1时细胞活力最弱(P<0.05);与阴性对照组相比,不同浓度的人参外泌体给药组对RAW264.7细胞活力的影响显著增强(P<0.01);与阳性对照组相比,不同浓度的人参外泌体对RAW264.7细胞活力的影响效果较弱(图1)。
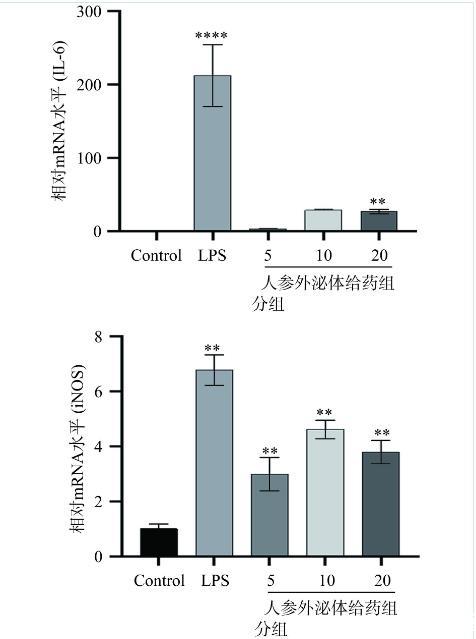
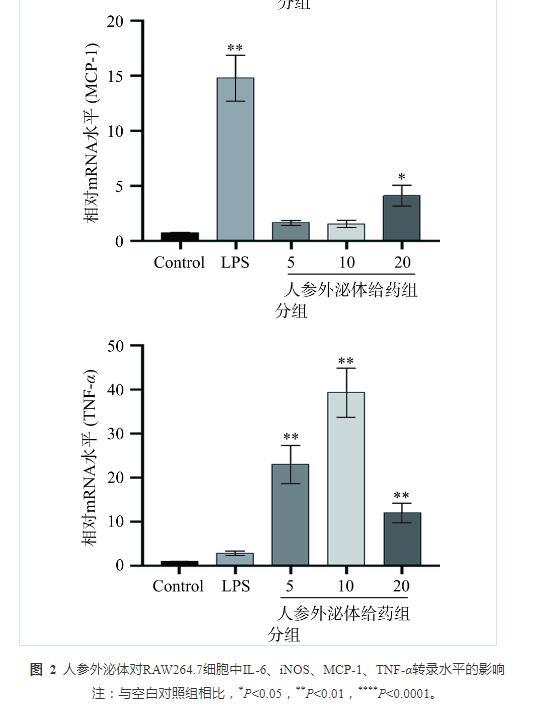
2.2人参外泌体对RAW264.7细胞中炎症因子转录水平的影响
M1巨噬细胞在炎症因子分泌和抗肿瘤免疫中发挥作用,从而保护宿主免受各种细菌和病毒的侵害[24]。基于广泛的研究,有人提出M1巨噬细胞在肿瘤细胞中的高浸润与NSCLC患者的预后改善有关[25]。为了探讨人参外泌体对巨噬细胞RAW264.7细胞极化的影响,采用实时定量PCR检测巨噬细胞RAW264.7中IL-6、iNOS、TNF-α、MCP-1转录水平的表达情况,结果显示(图2),与空白对照组相比,LPS组IL-6、iNOS、MCP-1、TNF-α转录水平升高;不同剂量的人参外泌体处理后,与空白对照组相比,人参外泌体低剂量组iNOS、TNF-α转录水平显著升高(P<0.01),IL-6、MCP-1无显著差异;人参外泌体中剂量组iNOS、TNF-α转录水平显著升高(P<0.01),IL-6、MCP-1无显著差异;人参外泌体高剂量组IL-6、iNOS、MCP-1、TNF-α转录水平显著升高(P<0.01)。因此,人参外泌体可显著诱导巨噬细胞RAW264.7细胞向M1型极化。