2、共生微生物调控昆虫脂质代谢
2.1 IIS通路介导的调控
在胰岛素/胰岛素样生长因子信号(insulin/insulin-like growth factor signaling,IIS)通路中,胰岛素分泌细胞产生的胰岛素样肽(insulin-like peptides,ILPs)与细胞膜上的胰岛素受体结合,引发细胞内的级联反应,激活下游激酶如磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和蛋白激酶B(protein kinase B,Akt),从而影响下游过程,包括抑制叉头转录因子O家族(fork head transcription factor O,FoxO)的核易位、激活固醇调节元件结合蛋白(sterol regulatory element‐binding protein,SREBP),进而诱导果蝇脂肪体合成甘油三酯。当IIS通路减弱时,FoxO被去磷酸化并进入核内,激活下游靶基因,启动brummer的表达,进而催化甘油三酯分解(图1)。
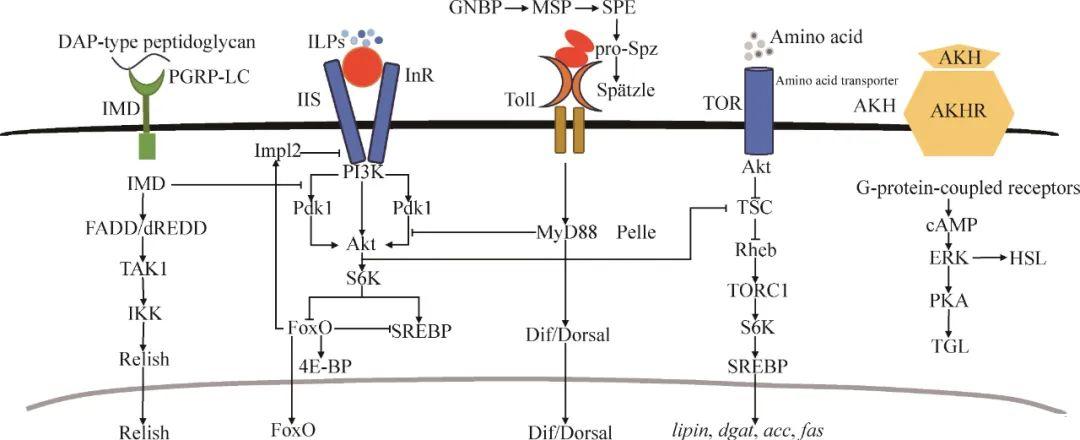
▲图1昆虫主要的免疫信号通路和胰岛素信号通路及其相互作用
共生微生物能激活昆虫的IIS通路。当黑腹果蝇感染果实醋杆菌(Acetobacter pomorum)、植物乳杆菌(Lactobacillus plantarum)或嗜昆虫假单胞菌(Pseudomonas entomophila)后,其脂肪体内的IIS通路被激活,Akt磷酸化水平增加,同时FoxO靶基因表达水平降低。然而,一些研究得出了相反的结论。例如,当黑腹果蝇感染海分枝杆菌(Mycobacterium marinum)或球孢白僵菌(Beauveria bassiana)后,其脂肪体内的Akt磷酸化水平降低,而FoxO靶基因的表达水平上调。这些结果说明,共生微生物对宿主IIS通路的影响因微生物种类的不同而有所差异,也意味着共生微生物能通过调控IIS通路来影响宿主的脂质代谢。
进一步研究发现,共生微生物通过产生乙酸、丙酸和丁酸等短链脂肪酸来激活IIS通路,进而影响昆虫体内的脂质代谢。例如,黑腹果蝇肠道内的路氏肠杆菌(Enterobacter ludwigii)、果实醋杆菌和植物乳杆菌产生的乙酸,可以促进DILP2和DILP5的表达,从而激活IIS通路,导致果蝇体内甘油三酯含量增加。与此相反,病原菌可以刺激宿主消耗乙酸,进而抑制IIS通路。例如,当黑腹果蝇感染病原菌霍乱弧菌(Vibrio cholerae)后,其乙酰辅酶A合成酶-1基因的表达水平上调,导致乙酸消耗量增大,肠道中乙酸水平下降,从而抑制IIS通路,干扰宿主的肠道脂质代谢(图2)。
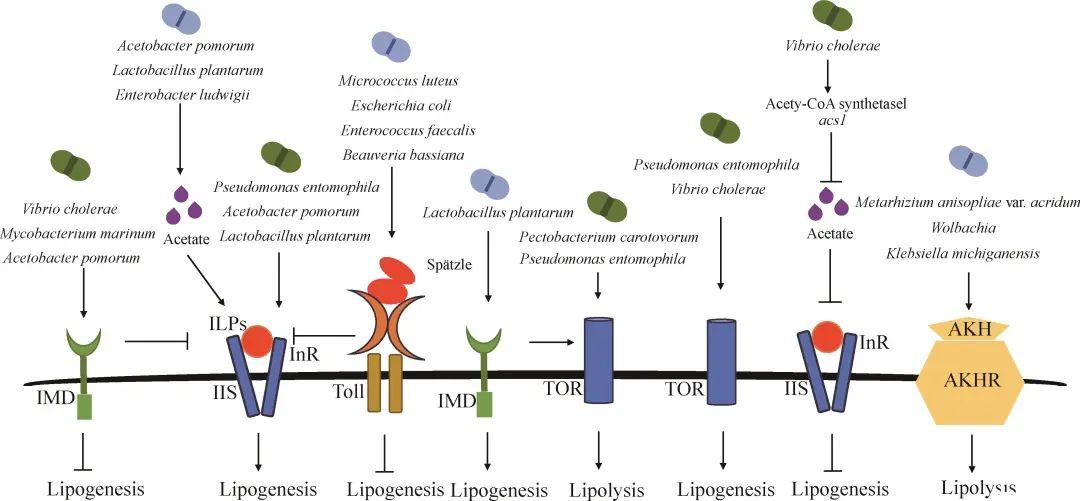
▲图2共生微生物对昆虫脂质代谢的影响
2.2 IMD/IMD-IIS信号通路介导的调控
免疫缺陷(immune deficiency,IMD)信号通路在黑腹果蝇体内(包括肠道和脂肪体)发挥着重要的免疫调节作用,参与抵御革兰氏阴性菌以及部分革兰氏阳性菌的感染。当细菌细胞壁中的二氨基庚二酸型肽聚糖与宿主细胞膜上的肽聚糖识别受体(peptidoglycan recognition protein LC,PGRP-LC)结合后,IMD蛋白开始募集FADD蛋白(fas-associated death-domain-containing protein)和dREDD蛋白(death-related ced-3/Nedd2-like protein)形成复合体,并通过蛋白激酶TAK1(transforming growth factor-activated kinase 1)来激活IκB激酶(inhibitor ofκB kinase,IKK)复合体,活化的IKK复合体激活转录因子Relish,促使Relish发生核易位,并启动抗菌肽的表达(图1)。
共生微生物可以通过激活昆虫体内的IMD信号通路来调控速激肽(tachykinin,Tk)的表达。例如,当黑腹果蝇感染果实醋杆菌后会激活IMD信号通路,促进果蝇中肠内分泌细胞合成速激肽。速激肽会与G蛋白偶联受体TKR99D/PKA(protein kinase A)信号传导途径相互作用,抑制肠壁细胞中SREBP的表达,从而抑制肠道内脂肪酸合成酶和乙酰辅酶A羧化酶的表达,进而抑制脂肪合成。据此推测,共生微生物可以通过IMD-Tk途径来调控宿主的脂质代谢。此外,共生微生物还能通过激活IMD信号通路来调控IIS通路,影响昆虫体内脂质代谢。例如,当黑腹果蝇感染病原菌霍乱弧菌或海分枝杆菌后,激活的IMD信号通路会通过抑制Pdk1(serine/threonine kinase 3-phosphoinositide-dependent protein kinase 1)来降低IIS通路的活性,导致FoxO的关键靶基因Impl2和4E-BP的表达上调,而Impl2的过表达会进一步抑制IIS通路的活性,从而导致果蝇脂肪体中的脂质含量下降(图2)。
2.3 Toll/Toll-IIS信号通路介导的调控
在昆虫肠道和脂肪体中,真菌和革兰氏阳性菌感染会激活Toll信号通路。革兰氏阴性菌结合蛋白(Gram-negative binding protein,GNBP)受体识别病原菌细胞壁中的赖氨酸型肽聚糖,进而激活模块化丝氨酸蛋白酶(modular serine protease,MSP)的级联反应。这一级联反应通过由Spӓtzle激活酶和Spӓtzle加工蛋白酶介导的裂解过程,使下游配体Spätzle产生活性,随后配体Spätzle与Toll受体结合,进而激活接头蛋白MyD88和Pelle,促进转录因子Dif/Dorsal的核易位,最终启动载脂蛋白基因表达(图1)。例如,家蚕(Bombyx mori)和黄粉虫(Tenebrio molitor)在感染病原菌如球孢白僵菌、单核增生李斯特氏菌(Listeria monocytogenes)或大肠埃希氏菌(Escherichia coli)后,可以激活Toll信号通路,启动载脂蛋白III转录,从而促进宿主脂质的转运。
共生微生物还可以通过激活Toll信号通路来抑制IIS通路,进而影响昆虫体内的脂质代谢。黑腹果蝇感染藤黄微球菌(Micrococcus luteus)、大肠埃希氏菌、粪肠球菌或球孢白僵菌后,会激活脂肪体中Toll信号通路中的接头蛋白MyD88,MyD88通过作用于PI3K或PI3K下游蛋白激酶Pdk1来降低Akt的磷酸化水平,同时Toll信号通路还会降低DILP6的表达。IIS通路的减弱会活化FoxO,进而促进brummer的表达,导致昆虫脂肪体中脂质含量降低(图2)。
