2、结果
2.1菌液的特异性与纯度检验结果
经纯检,48 h后普通营养琼脂平板表面无细菌长出,表明细菌培养过程中无污染;菌落PCR检测在500 bp处出现了清晰的电泳条带(图1),表明本试验培养的3个菌株皆为副鸡禽杆菌。
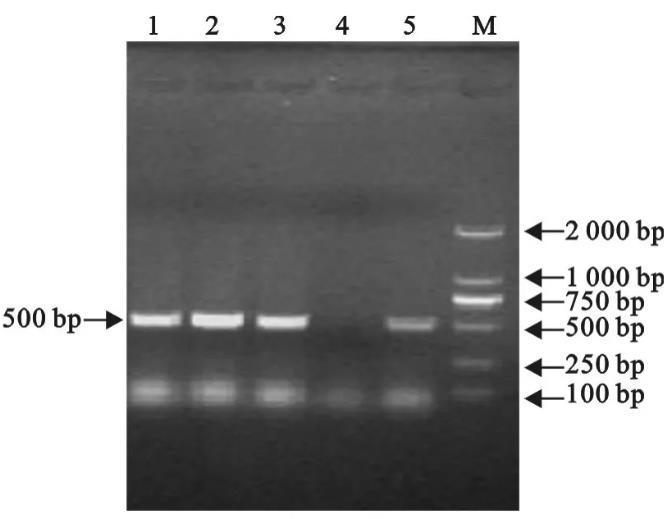
图1副鸡禽杆菌A、B、C 3个血清型参考菌株的PCR检测结果
2.2分光光度法和菌落计数法绘制副鸡禽杆菌A、B、C 3个血清型参考菌株的生长曲线
采用菌液OD 600 nm值和活菌计数值(cfu/m L)的对数为纵坐标分别绘制3个血清型参考菌株的生长曲线(图2,图3)。图2是以菌液OD 600 nm值为纵坐标绘制的生长曲线,3个血清型参考菌株生长规律基本一致,即在监测之初5 h即进入了对数生长期,13 h达到稳定期,持续到14 h后OD 600 nm值开始急剧下降进入衰退期,15 h以后OD 600 nm值开始下降得比较缓慢。如图2所示,3个血清型菌株的生长稳定期都很短。
图3是以活菌计数值(cfu/m L)的对数为纵坐标绘制的生长曲线,3个血清型参考菌株在监测之初5 h即进入了对数生长期,C型菌株达到生长高峰的时间最短,为10 h,但是C型达到生长高峰时的活菌数却最少,为15亿;其次是A型,培养11 h达到活菌数高峰,为31.6亿;B型培养至12 h达到活菌数高峰,为43亿。3个血清型菌株达到生长高峰后的1 h内,A型和C型活菌数衰减大约2/3,B型活菌数衰减了14倍。因为在菌株生长高峰时段采用了1 h的监测频率,因此,3个血清型菌株的生长稳定期都短于1 h。
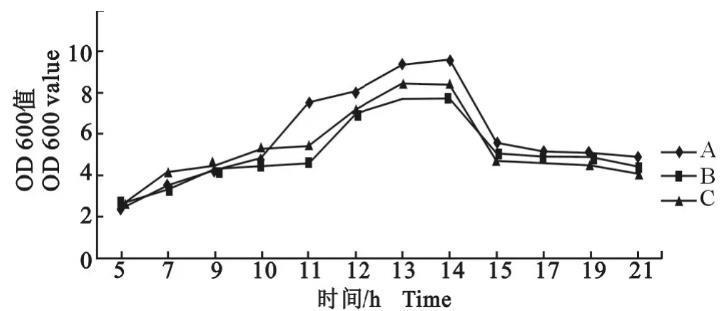
图2副鸡禽杆菌A、B、C 3个血清型参考菌株的生长曲线(分光光度法)
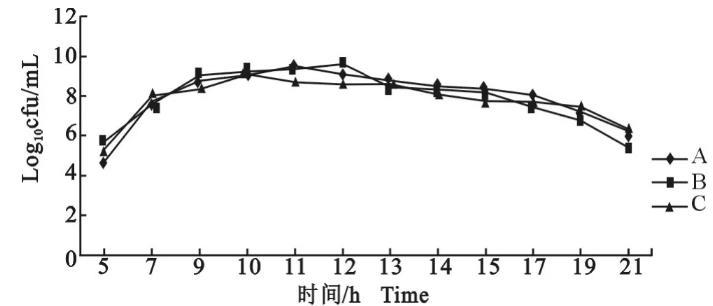
图3副鸡禽杆菌A、B、C 3个血清型参考菌株的生长曲线(活菌计数法)
2.3 3个血清型参考菌株在对数生长期和稳定期OD 600 nm值和活菌数之间的函数关系
由图2和图3可看出,分光光度法和菌落计数法的生长曲线差异较大,当菌液OD 600 nm值达到最高值时活菌数已不是最多,二者之间不呈线性相关。取3个血清型菌株对数生长期至稳定期的数据,以OD 600 nm值为横坐标,菌液中活菌数对数为纵坐标,绘制两者的回归曲线,结果为一元二次多项式回归,见图4、图5和图6。3个血清型参考菌株的回归方程分别为y=-25.60x2+34.75x-1.789,相关指数R2=0.913(A型);y=-42.90x2+50.04x-4.513,相关指数R2=0.995(B型);y=-23.03x2+30.31x-0.715,相关指数R2=0.936(C型)。3个血清型回归方程的拟合度都比较高,其中,以B型回归方程估测的可靠程度最高,其次是C型和A型。

图4 A型参考菌株OD 600 nm值与活菌数对数之间的函数关系图
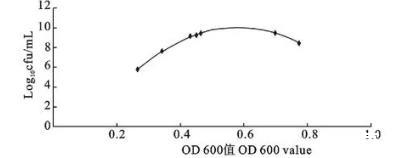
图5 B型参考菌株OD 600 nm值与活菌数对数之间的函数关系图
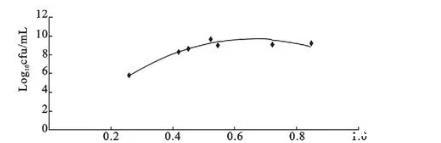
图6 C型参考菌株OD 600 nm值与活菌数对数之间的函数关系图
3、讨论
细菌的生长曲线反映了细菌在培养过程中生长、繁殖和衰亡的规律,在适宜条件下培养,会出现延滞期、对数生长期、稳定期和衰退期4个阶段。在研究细菌的各种特性时,生长曲线有助于选择到生长状态比较一致的细菌,一般选择刚开始进入平台期的细菌。因此,在进行细菌生物特性比较研究之前,找到细菌的稳定期,对于试验结果的可靠性有着重要的意义。
本试验比较了3个不同血清型副鸡禽杆菌参考菌株在体外培养条件下的生长曲线,采用分光光度法和活菌计数法两种方法,两种方法获得的生长曲线差异较大,不能用菌液OD 600 nm值来直接衡量活菌数的多少。在对数生长期和稳定期,菌液OD 600 nm值和活菌数之间不呈现线性关系,而是呈现比较复杂的一元二次多项式回归关系,这一特性与其他菌的相关报道不一致[4-6]。这与菌种本身的特性有关,因为副鸡禽杆菌是一种非常敏感的细菌,对外界温度及理化因素的抵抗力均较弱,在固体培养基上的菌落,4℃下存放超过5 d~7 d,就不再有存活的细菌。在适宜液体培养基中,常温下衰亡的速度也很快,反复冻融会大大降低菌液中的活菌数。
另外,副鸡禽杆菌在体外培养的生长要求苛刻,大多数菌株需要还原型辅酶A,即使如此,本菌的生长和繁殖能力也无法和其他禽类的致病菌相比,3个血清型菌株达到生长高峰时的活菌数只能与静置培养的大肠埃希菌[8]、鸭疫里默菌活菌数相当,只有摇振培养的鸭疫里默菌活菌数的1/10[9]。而且,该菌的生长稳定期非常短暂,因此,在培养副鸡禽杆菌进行灭活疫苗生产时,一定要把握好收获菌液的时间。
本试验结果不但为进一步菌株生物学特性比较奠定了基础,而且为今后的副鸡禽杆菌毒力比较试验及疫苗的研制奠定了基础。
相关新闻推荐
1、不同pH、Na2CO3、NaCl浓度对耐盐碱菌株NM-1生长曲线的影响——材料与方法
