L-苹果酸是生物体内三羧酸循环的重要一员,在生物体中具有重要的生理功能[1];同时也是天然果酸的重要组成部分,其酸味持久柔和,是优良的酸味剂。因为上述特性,L-苹果酸在医药、食品等多个行业中都有广泛用途[2]。合成单一手性的L-苹果酸主要方法有细胞/酶转化法和微生物发酵法[3],胡永红等[4]以富马酸钙为底物,采用游离延胡索酸酶,直接转化生成苹果酸钙,在40℃、pH 7.0~7.5的条件下,每升延胡索酸酶液能在20~28 h可将3.2 kg的富马酸钙转化生成苹果酸钙,转化率高达99.9%;周小燕等[5]使用L-苹果酸高产突变株曲霉N1-14'在5 L罐上发酵120 h,L-苹果酸产量达105.88 g/L,平均产生速率0.883 g/(L·h),糖酸转化率78.43%。
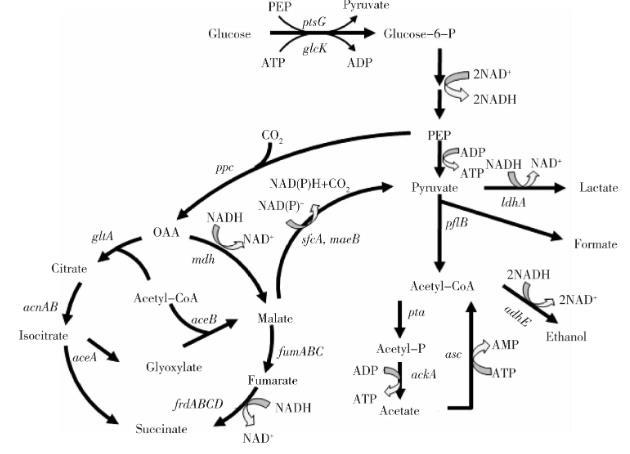
图1野生大肠杆菌厌氧混合酸发酵途径
大肠杆菌遗传背景清楚、易于进行代谢调控,操作简便,在厌氧条件下进行混合酸发酵(图1),可发酵糖生成甲酸、乙酸、乳酸、琥珀酸和乙醇等产物。通过代谢工程和基因敲除技术对大肠杆菌代谢途径进行改造,可消除副产物的积累,提高目的产物的产量。如Zhou等[6]和Jantama等[7]利用基于FLP/FRT重组酶系统的基因敲除技术对大肠杆菌的代谢途径进行改造,获得生产不同物质的重组大肠杆菌,其产物包括乙醇、丙酮酸、乳酸和琥珀酸等。基于此研究思路,在大肠杆菌中构建L-苹果酸的合成途径,同时消除杂酸的影响,有可能获得较高的产量与转化率。
笔者以所在实验室前期构建的产琥珀酸重组大肠杆菌E.coli B0013-1050[8](敲除乙酸激酶、磷酸乙酰转移酶基因ackA-pta、乳酸脱氢酶基因ldhA、丙酮酸甲酸裂解酶基因pflB、乙醇脱氢酶基因adhE和酶IICBGlc编码基因ptsG)为出发菌株,利用Red同源重组结合Xer/dif重组技术[9-10]继续敲除富马酸酶基因和苹果酸酶基因,构建1条葡萄糖-PEP-草酰乙酸-L-苹果酸的合成途径,以实现L-苹果酸在大肠杆菌中的积累。在此基础上,通过克隆表达来源于黄曲霉的苹果酸脱氢酶基因,强化合成途径,进一步提高L-苹果酸的转化率。
1、材料与方法
1.1材料与试剂
1.1.1菌株和质粒
重组菌株E.coli 2010、E.coli 2020、E.coli 2030、E.coli 2040和重组菌E.coli B0013-1050由笔者所在实验室研究人员构建。
质粒:质粒pSK-difGm和同源重组的协助质粒pKD46、质粒pNpheA保藏于笔者所在实验室;重组质粒pMD18-T-fumB'::difGm、pMD18-T-fumC'::difGm、pMD18-T-maeB'::difGm、pUC19-pNmdh、pBR322-pNmdh和pTH18-pNmdh、pMD18-T-maeB'::difGm-pNmdh均为笔者所在研究课题组研究人员构建。
1.1.2引物
本研究课题设计的引物(表1)均交由上海生工生物工程公司代为合成。
1.1.3工具酶和试剂
所用DNA限制性内切酶EcoRI、BamHI、SmaI、HindIII和KpnI,Taq DNA聚合酶,反转录试剂盒均购自Fermentas公司;T4 DNA连接酶、pMD18-T simple vector、pfu高保真DNA聚合酶均为宝生生物工程有限公司产品;小量质粒快速提取试剂盒、小量DNA片段纯化回收试剂盒和小量DNA片段胶回收试剂盒为北京博大泰克生物基因技术有限责任公司产品;L-阿拉伯糖购自上海生工生物工程公司;酵母提取物和胰蛋白胨为Oxoid公司产品;其他试剂药品均为国产分析纯。

表1本研究中所用引物
1.1.4培养基
LB培养基(g/L):胰蛋白胨10,酵母浸出物5,NaCl 10。配制固体培养基时加入15 g/L琼脂粉。
M9培养基(g/L):Na2HPO4·12H2O 15.12,KH2PO43.0,NaCl 0.5,NH4Cl 1.0。使用时需按体积分数0.1%的量补加Mg2+(1 mol/L)和微量元素,并添加适量葡萄糖溶液作为C源。
微量元素(mmol/L):FeCl3·6H2O 8.88,CoCl2·6H2O 1.26,CuCl2·2H2O 0.88,ZnCl22.20,Na2MoO4·2H2O 1.24,H3BO31.21,MnCl2·4H2O 2.5。
抗生素:氨苄青霉素,终质量浓度100μg/mL;庆大霉素,终质量浓度30μg/mL;卡那霉素,终质量浓度30μg/mL。
1.2方法
1.2.1目标基因的敲除
利用Red同源重组结合Xer/dif重组技术依次敲除富马酸酶基因fumB和fumC,苹果酸酶基因sfcA和maeB。参照文献[9]的基因敲除方法,依次构建制备在dif-Gm-dif片段左右带有目标基因上下游各200 bp左右同源臂的突变盒。将已经导入质粒pKD46的大肠杆菌目标菌株在含氨苄青霉素的LB培养基中培养,加入L-阿拉伯糖诱导使其产生Red重组酶,制备感受态细胞,将同源重组片段与感受态细胞按适当比例充分混合,电击转化并后培养1 h,涂布氨苄青霉素和庆大霉素的双抗平板,30℃培养,挑选阳性转化子。以验证引物对其进行验证。将验证结果正确的菌株30℃下进行传代,使细胞内Xer重组酶系统发挥作用自动识别dif位点,切除dif位点间的抗性基因,完成目的基因的敲除。
1.2.2发酵及产物检测
摇瓶发酵:重组菌经平板活化,挑取单菌落接入LB培养基中,37℃、200 r/min培养10~12 h,离心收集菌体,加入适量M9重悬,转接M9培养基,葡萄糖初始质量浓度5 g/L,37℃、200 r/min培养12 h。补加葡萄糖溶液至糖质量浓度到30 g/L,以50 g/L的量加入CaCO3,塞上硅胶塞,转入厌氧发酵,37℃、200 r/min发酵36 h。
15 L罐发酵:重组菌的活化和转接与摇瓶发酵一致,M9中培养12 h后,作为发酵罐的种子液。发酵罐装液量为6 L,接种量为5%,发酵温度37℃,初始葡萄糖质量浓度5 g/L,通气量3 L/min,搅拌转速200 r/min,好氧培养使菌体生长,适时调节搅拌转速(200~500 r/min)使得溶解氧体积分数大于30%,以NH3H2O控制pH为7。有氧培养至菌体浓度达到最大,停止通气,搅拌速率降为100 r/min,进入厌氧转化阶段。按6 g/L加入NaHCO3,并以2.4 mol/L K2CO3和1.2 mol/L KOH溶液代替NH3H2O控制pH为7,37℃恒温厌氧发酵30 h。
产物检测:葡萄糖浓度使用生物传感分析仪(山东省科学院生物研究所)检测;有机酸产量由高效液相色谱测定仪,泵为Dionex P680,紫外检测器为Dionex UVD170U,色谱柱为反向C18色谱柱Nucleosil 100-5 C18,液相检测条件参照文献[11]。
1.2.3黄曲霉总RNA的提取及cDNA的制备
黄曲霉总RNA的提取方法参照文献[12],处理过后的总RNA按照反转录试剂盒的说明进行反转录PCR,得到cDNA,用于苹果酸脱氢酶基因mdh的PCR扩增。
1.2.4黄曲霉苹果酸脱氢酶基因mdh在重组菌中的表达
以质粒pNpheA(含有组成型启动子PN25)和黄曲霉cDNA为模版,通过重叠PCR扩增得到带有启动子PN25的mdh基因,连接不同拷贝数载体质粒(pUC19、pBR322和pTH18),构建重组质粒pUC19-pNmdh、pBR322-pNmdh和pTH18-pNmdh,并导入重组菌中进行表达。
