2、结果与讨论
2.1基因敲除重组菌的构建结果
图2为基因sfcA、fumB、fumC和maeB敲除验证结果。扩增sfcA基因时,先后使用2对不同的上下游引物进行PCR,但未得到任何扩增产物,推测sfcA基因已被敲除,再设计引物sfcA1和sfcA2,将目的基因包括其上下游各300 bp左右一起扩增,但PCR结果只有约200 bp,之后以野生菌E.coli B0013染色体为模板,PCR结果与预期(2379 bp)相符合,验证结果见图2(a)。由图2(a)可知:sfcA基因已被敲除,原因可能是在前期菌株改造过程中,某个突变盒的同源臂与该基因有较高同源性,导致基因同时被敲除。

图2基因敲除验证
基因fumB、fumC和maeB的敲除验证见图2(c)~图2(d),使用相同引物对出发菌株和基因敲除菌株进行PCR,扩增产物的大小有明显差异,证明目标基因片段已从染色体上删除。对3株基因敲除重组菌分别命名为E.coli 2010、E.coli 2020和E.coli 2030。对于fumA基因,考虑到其主要在有氧条件下作用[13],为保证菌体在有氧条件下的正常生长,本研究未对其进行敲除。
2.2重组菌的生理特性与发酵实验结果
利用Red同源重组系统结合Xer/dif重组酶系统,成功构建1株富马酸酶基因(fumB和fumC)和苹果酸酶基因(sfcA和maeB)重叠缺失突变株E.coli 2030,将该重组菌分别于LB和M9培养基中培养,测定600 nm处吸光值A600,以E.coli B0013-1050为对照菌株,绘制生长曲线,结果见图3。由图3可知:所构建的重组菌的生长状况对比于出发菌株没有太大差别,表明敲除fumB、fumC和maeB基因并不会对菌体的好氧生长产生影响。
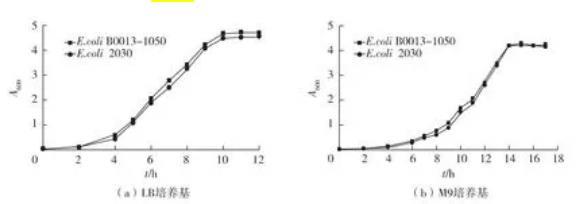
图3 E.coli B0013-1050及其突变株E.coli 2030的生长特性比较
对重组菌E.coli 2010、2020和2030进行摇瓶发酵试验,以出发菌E.coli B0013-1050作为对照,发酵结果见表2。由表2可知:敲除基因fumB的重组菌E.coli 2010厌氧发酵的主要产物是丙酮酸和琥珀酸,和出发菌相比较,琥珀酸的产量下降,葡萄糖-琥珀酸转化率由出发菌的38.9%下降为26%。而继续敲除fumC基因的重组菌E.coli 2020的琥珀酸产量却只有微弱的下降,并未到达预期中完全消除琥珀酸积累的目的。
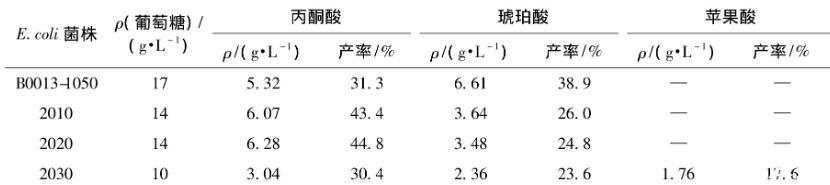
表2基因敲除重组菌摇瓶发酵结果
与之前2株重组菌相比,继续敲除苹果酸酶基因的重组菌E.coli 2030发酵产物中,琥珀酸的转化率变化不大,而丙酮酸的转化率下降,最终生成苹果酸1.76 g/L,葡萄糖-苹果酸转化率为17.6%。
重组菌2030在15 L罐中发酵,考察其产酸能力,发酵结果如图4所示。由图4可知:厌氧发酵30 h,耗糖24 g/L,最终产L-苹果酸12.5 g/L,葡萄糖-苹果酸转化率为52.1%,生产强度0.42 g/(L·h)。丙酮酸转化率下降到19.3%。发酵液中还检测到琥珀酸和少量的乳酸。
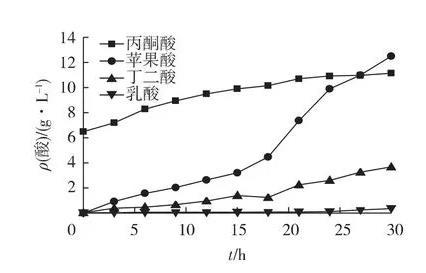
图4重组大肠杆菌E.coli 2030在15 L发酵罐中发酵产酸情况
2.3苹果酸脱氢酶基因mdh表达量对L-苹果酸产率的影响
苹果酸脱氢酶(malate dehydrogenase,MDH,EC 1.1.1.37)是笔者所构建的L-苹果酸合成途径中的一个关键酶,通过强化MDH的表达,可引导代谢流更多地走向L-苹果酸合成途径,提高目的产物的转化率。Peleg等[14]发现在黄曲霉中L-苹果酸的合成主要来自于草酰乙酸,苹果酸脱氢酶在L-苹果酸生产中起到了重要作用。本文此前构建的合成途径也是由草酰乙酸生成L-苹果酸,因此克隆了来源于黄曲霉的苹果酸脱氢酶基因mdh,连接至不同拷贝数载体,并在重组菌E.coli 2030中进行表达,考察其表达量对L-苹果酸产率的影响。
绘制含不同拷贝数质粒的重组菌在M9培养基中的生长曲线,结果见图5。由图5可知:在相同的培养条件下,携带高拷贝质粒的重组菌所能达到的菌体浓度明显小于携带中低拷贝数质粒的重组菌,这是因为更多的能量被用于蛋白质合成而影响了菌体的生长。其余2个重组菌的生长状况相似,对比于重组菌E.coli 2030,最终的菌体浓度也没有太大差别。这表明苹果酸脱氢酶的表达量应控制在中低水平,过高则会影响菌体的生长。
以菌株E.coli 2030作为对照,对含不同拷贝数质粒的重组菌进行摇瓶发酵试验,发酵结果见表3。由表3可知:厌氧发酵36 h后,相较于对照菌,L-苹果酸的产量和转化率都有不同程度的提高,并且随着拷贝数的降低,L-苹果酸的转化率也逐渐升高。上述结果表明,想要获得较好的强化作用,需要将苹果酸脱氢酶的表达量控制在较低的水平,而不是越高越好。
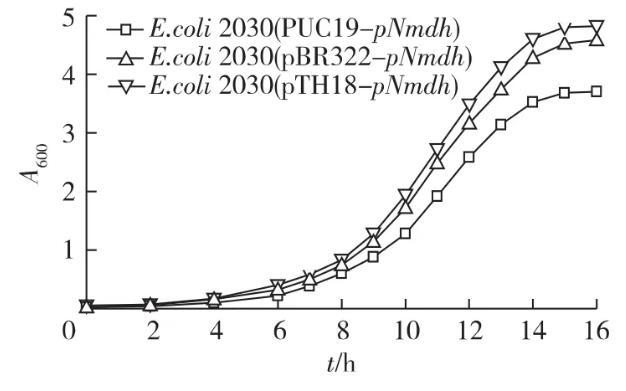
图5携带不同拷贝数质粒的重组菌生长曲线

表3含有不同拷贝数质粒的重组菌产L-苹果酸能力的比较
2.4重组菌E.coli 2040的构建及其发酵实验结果
为了实现苹果酸脱氢酶基因的稳定遗传并控制其表达量在较低水平,将mdh基因整合表达于重组菌中。根据之前的基因敲除方法,将同源重组突变盒maeB'::difGm连接至pMD18-T-maeB'::pNmdh,构建突变盒maeB'::difGm-pNmdh,使用该突变盒在敲除maeB基因的同时,将基因mdh整合于重组大肠杆菌染色体上。基因整合的验证结果见图6。由图6可知,mdh已整合于重组菌染色体上,将该菌命名为E.coli 2040。
图7为E.coli 2040在15 L罐中厌氧发酵结果。由图7可知:厌氧发酵30 h,耗糖23.2 g/L,最终产L-苹果酸14 g/L,葡萄糖-苹果酸转化率为60.3%,生产强度0.47 g/(L·h)。
对于利用大肠杆菌直接发酵生产L-苹果酸,国内外学者已有一定的研究,Zhang等[15]以产琥珀酸重组大肠杆菌KJ073为出发菌,继续敲除富马酸酶fumAC和fumB,延胡索酸还原酶frdBC,苹果酸酶sfcA和maeB,得到菌株XZ658,在3 L罐中,经两段式发酵72 h,耗糖32.8 g/L,最终产苹果酸34 g/L,葡萄糖-苹果酸转化率为103.8%,生产强度0.47 g/(L·h),其他的杂酸只有少量的琥珀酸、乳酸和乙酸(1 g/L左右),是目前产L-苹果酸大肠杆菌中转化率最高的1株。但由于fumA基因的缺失,重组菌的生长受到影响,导致发酵周期的延长(有氧培养16 h,发酵周期72 h)。本文菌株拥有较好的生长性能,可为后期的厌氧转化提供较高的初始菌体浓度,并缩短整个发酵周期,在此基础上继续对菌株进行改造,提高苹果酸的产量及转化率,则可获得性能更为优良的菌株。
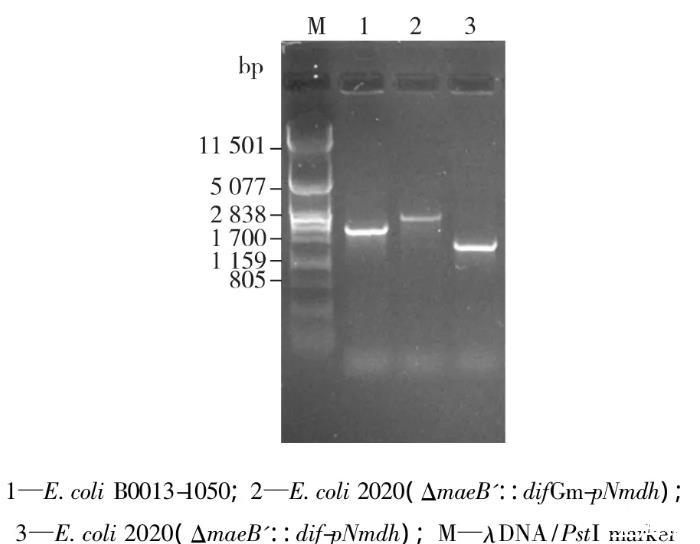
图6 mdh基因整合表达的验证
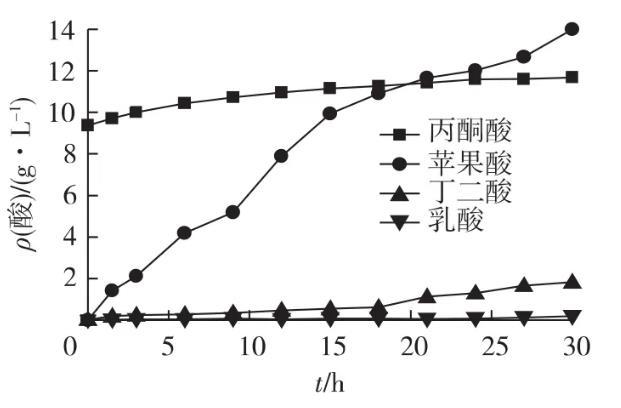
图7重组大肠杆菌E.coli 2040在15 L发酵罐中发酵产酸情况
3、结论
基于重组大肠杆菌E.coli B0013-1050的琥珀酸生成途径,利用Red同源重组结合Xer/dif重组系统敲除富马酸酶基因fumB和fumC,苹果酸酶基因sfcA和maeB,成功构建L-苹果酸合成途径,经15 L罐发酵产L-苹果酸12.5 g/L,葡萄糖-苹果酸转化率为52.1%,主要杂酸为丙酮酸及琥珀酸;之后引入来源于黄曲霉的苹果酸脱氢酶,强化该途径,使L-苹果酸产量提高到14 g/L,葡萄糖-苹果酸转化率提高到60.3%,同时降低了丙酮酸及琥珀酸的转化率。
相关新闻推荐
2、应用细胞成像分析装置评价黄芩甙元、壳聚糖和念珠菌和地衣酸对假丝酵母菌和克鲁斯假丝酵母菌中生物膜的影响
