2.4 mogR的缺失对Lm低温生长的影响(growth curve)
本研究分别在4、28、37℃条件下培养菌株ATCC 19115、ΔmogR、cΔmogR、ΔflaA和cΔflaA,测定菌液OD600值,绘制生长曲线(图9),计算曲线下面积(area under the curve,AUC)(图10A–10C)和曲线下面积差异(ΔAUC)(图10D),以分析鞭毛的产生对Lm低温生长的影响。
结果显示,在4℃时,与亲本株ATCC 19115相比,缺失株ΔmogR(图9A)和回补株cΔflaA(图9B)的生长能力下降,其AUC值分别为13.2和13.5(图10A),比亲本株的AUC值(14.6)低9.84%和8.07%(P<0.05)(图10D);回补株cΔmogR(图9A)和缺失株ΔflaA(图9B)在对数期和稳定期的生长均高于亲本株,其AUC值分别为16.6和20.7(图10A),比亲本株的AUC值(14.6)高13.67%和41.22%(P<0.01)(图10D)。在28℃时,5个菌株的生长无显著性差异(图9C、图10B和10D)。5个菌株在37℃时的情况与4℃时的相似(图9D、图10C和10D)。结果表明,4℃时MogR对鞭毛合成的抑制作用有助于Lm低温生长。
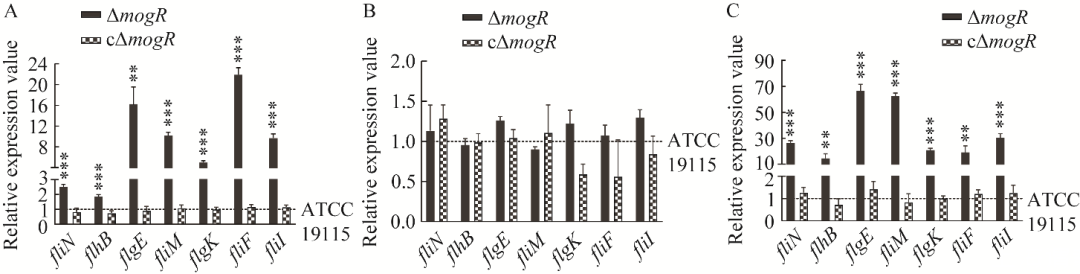
图8ΔmogR和cΔmogR的鞭毛基因fliN、flhB、flgE、fliM、flgK、fliF和fliI在4℃(A)、28℃(B)和37℃(C)条件下相比于亲本株ATCC 19115的相对转录表达水平
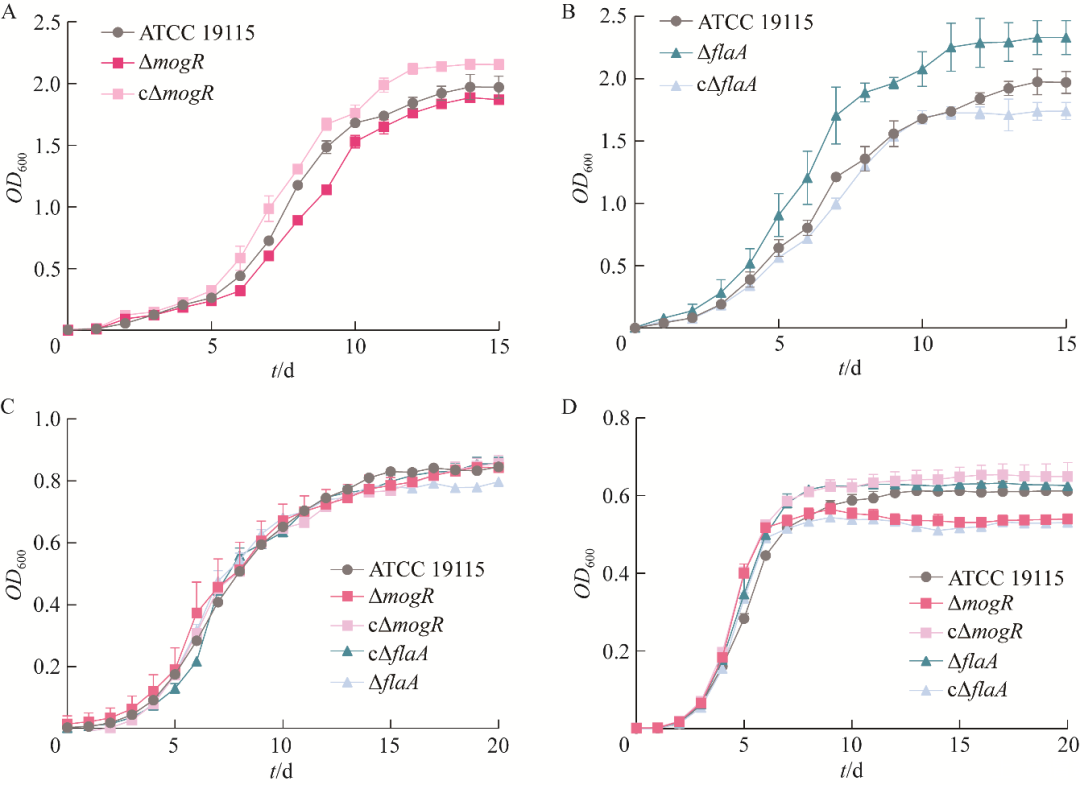
图9 ATCC 19115、ΔmogR、cΔmogR、ΔflaA和cΔflaA在4℃(A和B)、28℃(C)和37℃(D)条件下的生长曲线
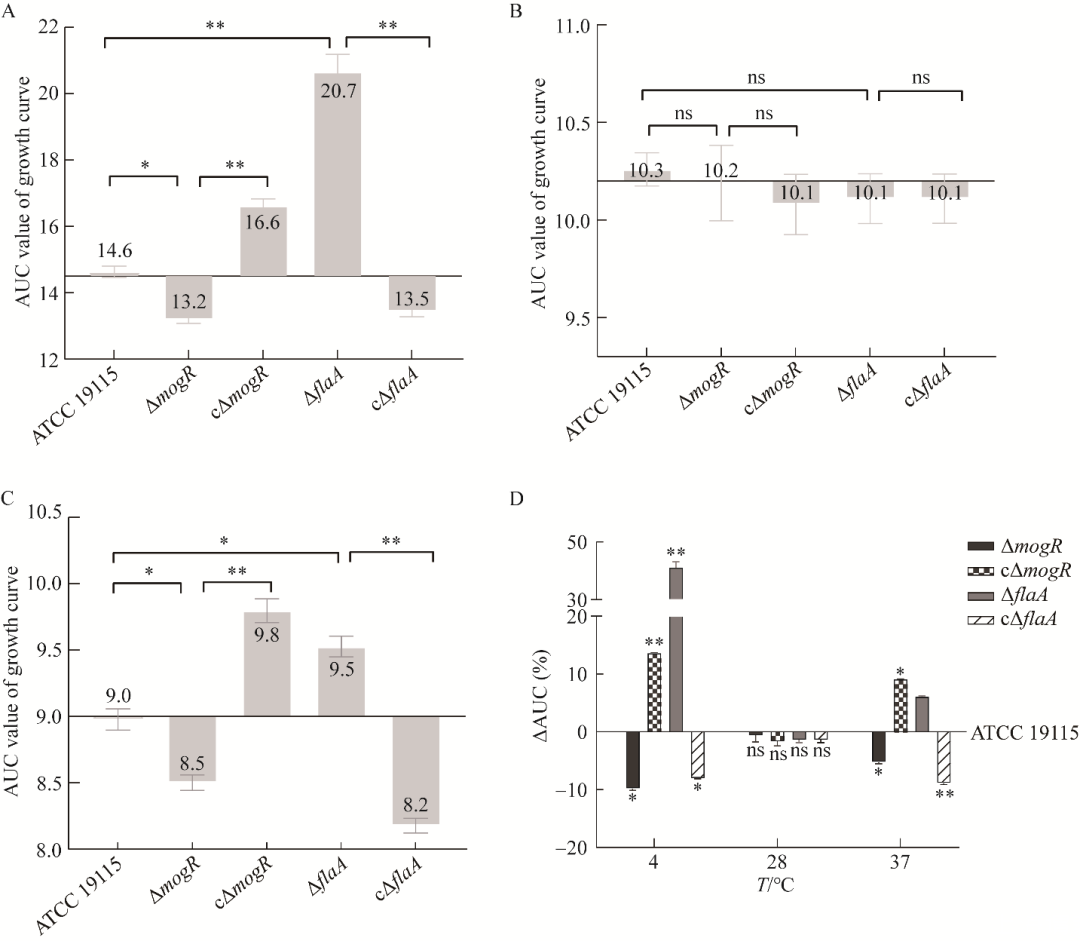
图10 ATCC 19115、ΔmogR、cΔmogR、ΔflaA和cΔflaA在4℃(A)、28℃(B)和37℃(C)条件下的生长曲线的曲线下面积值和与亲本株相比的曲线下面积差异ΔAUC(D)
3讨论
3.1低温下Lm的运动能力和鞭毛表达量不具有血清型特异性
Lm有14个血清型:1/2a、1/2b、1/2c、3a、3b、3c、4a、4ab、4b、4c、4d、4e、7[16]和4h[17],其中1/2a、1/2b、1/2c和4b是食品和临床病例中最常分离到的血清型,约占所有血清型的95%[18-19]。本研究选取来自这4个血清型的菌株ATCC 19115(4b)、ATCC 19111(1/2a)、YSP2019032612(1/2b)和Lm210722566(1/2c),通过运动性试验和RT-qPCR测定了菌株在4、28、37℃生长时的运动能力和鞭毛基因表达情况,发现所有菌株4℃时的结果均显著低于28℃时的结果(P<0.01或P<0.001),且所有菌株37℃时的结果与4℃时的相似(图11、图12),表明低温4℃时Lm鞭毛表达低是非血清型特异性的,因此本研究选择Lm ATCC 19115(4b)菌株为亲本株进行了深入的研究。
3.2 MogR的抑制蛋白GmaR在鞭毛基因表达中发挥作用
Lm在20−30℃条件下,MogR被抗阻遏蛋白GmaR抑制,MogR对鞭毛基因表达的抑制被解除,Lm产生鞭毛[7,10,20]。GmaR是温度感应蛋白,在37℃时,GmaR单体蛋白凝集在一起,无法与MogR结合,不能发挥抗阻遏作用,导致MogR抑制鞭毛基因表达;在30℃时,GmaR单体蛋白与MogR结合,使MogR离开鞭毛基因启动子,从而使鞭毛基因得以表达[11]。本研究结果表明4℃时MogR抑制了Lm鞭毛的形成,说明MogR未被GmaR抑制。那么4℃时GmaR是否如同在37℃时一样处于单体聚集状态,不与MogR结合,不发挥抗MogR阻遏作用,使MogR发挥抑制鞭毛基因表达的功能?我们正在进行这方面的探究。
3.3 MogR对Lm鞭毛基因表达的抑制作用与DegU相关
Lm在20−30℃条件下能形成鞭毛,除了GmaR发挥对MogR的抑制作用外,还需要双组分系统(HK/RR)中的孤儿RR DegU的正调控作用。DegU结合到fliN-gmaR操纵元(即operon 394)的启动子区域以调控gmaR的表达(图1),DegU的结合位点不与MogR的结合位点重叠,而且能以非磷酸化形式起作用[7,20-21]。本研究结果表明低温4℃时MogR对Lm的鞭毛基因表达有抑制作用,说明GmaR未阻遏MogR的作用。那么是否表明,低温4℃时gmaR的表达未受到DegU的正调控,gmaR没有表达出GmaR蛋白而无法行使对MogR的阻遏作用?这还有待进一步探究。

图11 Lm菌株ATCC 19115、ATCC 19111、YSP2019032612和Lm210722566分别在4、28、37℃下的运动能力(A)及运动圈的直径大小(B)
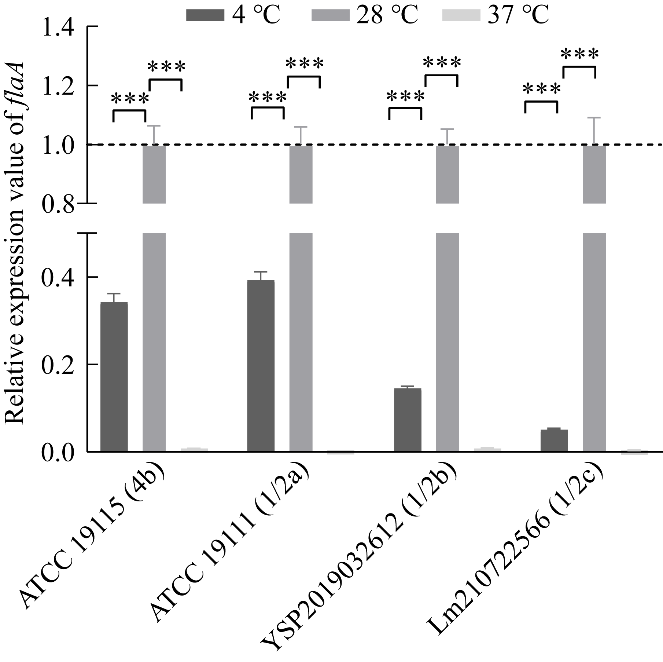
图12与28℃相比,4℃和37℃条件下Lm菌株ATCC 19115、ATCC 19111、YSP2019032612和Lm210722566的鞭毛丝蛋白基因flaA的相对表达量
3.4鞭毛的产生与Lm低温生长的关系
研究发现,在冷藏温度4−8℃时,Lm下调鞭毛基因表达量以降低其运动性来维持生长,生长快的菌株的鞭毛基因表达量显著低于生长慢的菌株,且随着时间的推移,生长慢的菌株运动性会更强,但未阐明具体机制[5-6]。本研究结果显示,在4℃时,mogR缺失后,Lm的鞭毛基因转录不被抑制,鞭毛基因表达量显著高于亲本株(图7、图8),鞭毛合成量显著多于亲本株(图5、图6),运动性显著强于亲本株(图4),生长能力显著弱于亲本株(图9、图10),表明鞭毛的产生会降低Lm在4℃时的生长速率。
4结论
本研究构建了Lm鞭毛基因转录阻遏蛋白MogR和鞭毛丝蛋白FlaA的缺失株ΔmogR和ΔflaA,以及相应的回补株cΔmogR和cΔflaA,测定了菌株分别在4、28、37℃时的运动性、鞭毛产生情况和鞭毛基因表达量,结果表明Lm在4℃时鞭毛产量少与MogR的抑制作用有关;本研究测定了菌株分别在4、28、37℃时的生长曲线,通过分析发现,在低温条件下Lm能生长繁殖与MogR对鞭毛基因表达的抑制作用有关。本研究为揭示Lm低温生长机制提供了新的信息。
