拥有与自身共生的微生物群落,在复杂多细胞生物中是一个普遍现象。对于人类和常见的动物而言,这些共生微生物有很大一部分定植在消化道——尤其是肠道中,即“肠道微生物组”。肠道微生物组是极其庞大复杂又处于动态变化中的微生态系统,在漫长的演化过程中,这些微生物与宿主形成了牢固的共生关系,为宿主提供一些重要的生理功能支持,例如合成某些维生素等必需的营养物质,通过定植抵抗机制保护宿主抵御病原体侵袭,是宿主健康不可分割的一部分。
肠道微生物研究领域的奠基可追溯到19世纪末到20世纪初,莱迪、巴斯德、梅契尼可夫、科赫、埃舍里希等科学先驱的一系列工作,使人们开始意识到微生物对人类健康和疾病发挥重要作用。而在应用层面,我国早在古代就已经开始利用基于肠道微生物的“黄龙汤”治病。
20世纪的肠道微生物研究主要围绕病原菌和益生菌展开。那时的研究者主要采用分离培养的方法,以单个细菌物种为研究对象,解析其特性和功能,进一步推动了人们对于肠道微生物在宿主健康中的作用及其与宿主相互作用的机制的认知。然而,这种研究模式对于解析庞大复杂的肠道微生物群而言,依然是管中窥豹。
随着研究技术的不断进步,尤其是高通量测序技术、计算机算力、生物信息学方法的发展、提升和应用,以及日益普遍、复杂的跨学科合作,肠道微生物组研究在21世纪初期开始了快速发展。科学界对于肠道微生物组对健康与疾病作用的理解与日俱增,使得公众和产业界也开始将目光转向这一新兴领域。再加上大型研究项目如美国人类微生物组计划(HMP)、欧洲人类肠道宏基因组计划(MetaHIT)开展和资金资源投入的共同作用,促成了肠道微生物组领域在过去20年里的蓬勃发展,并逐渐成为现代医学和生物学研究的一个重要分支。
1医药转化
肠道菌群的紊乱和许多疾病有关,因此微生物组在疾病的预防、诊断、干预、预后等方面均有应用潜力。近年在微生物组医药转化方面的研究主要可以归纳为3大类——肠道微生物组的标志物、肠道微生物组的干预治疗、肠道微生物组与药物的相互作用,最终目的是将肠道微生物组纳入精准医疗,以实现的疾病个体化预防和治疗。
1.1高影响力研究者
“医药转化”主题的高影响力研究论文的作者姓名词云和核心研究团队(以通讯作者为准)及代表性研究,分别详见图1.1、表1.1。

图1.1“医药转化”主题的作者姓名词云
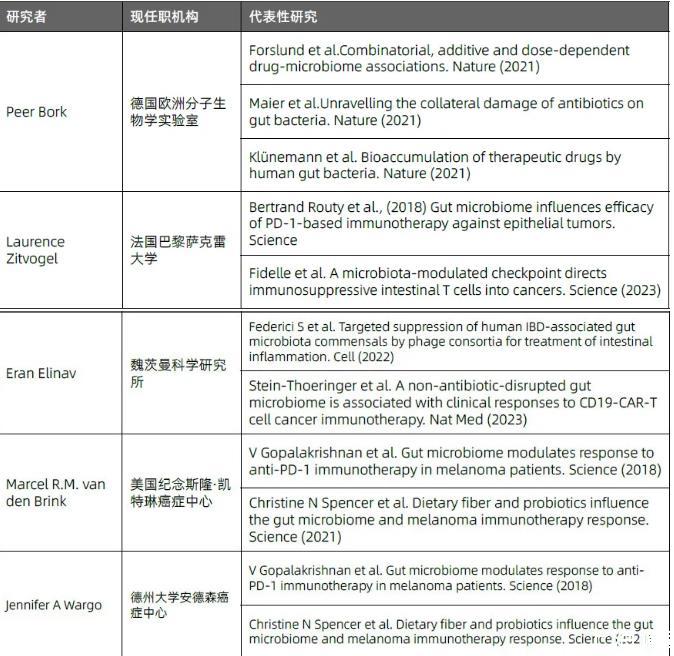
表1.1“医药转化”主题的代表性研究者
1.2主要认知和研究现状
“医药转化”主题高影响力研究论文的关键词词云如图1.2所示。通过Citespace文本挖掘,该主题的常见名词(term)包括粪菌移植(fecal microbiota transplantation)、炎症性肠病(inflammatory bowel disease)、短链脂肪酸(short-chainfatty acids)、嗜黏蛋白阿克曼(Akkermansia muciniphila)、免疫检查点抑制剂(immune checkpoint inhibitors)、肠道菌群失调(gut dysbiosis)、胆汁酸(bile acids)、肠-脑轴(gut-brainaxis)、氧化应激(oxidative stress)、微生物代谢物(microbialmetabolites)、抗生素治疗(antibiotic therapy)、糖尿病(diabetesmellitus)、药物代谢(drug metabolism)等。

图1.2“医药转化”主题高影响力研究论文的关键词词云
1.2.1基于肠道微生物组的疾病标志物
肠道微生物组可为疾病的筛查、诊断和预后提供潜在的生物标志物。
大量研究表明,癌症(如结直肠癌)、消化系统疾病(如炎症性肠病、肠易激综合征)、神经系统疾病(如自闭症、阿尔茨海默病)、心血管疾病、代谢性疾病(如脂肪肝病、2型糖尿病)、自身免疫疾病(如关节炎、肠道微生物组可为疾病的筛查、诊断和预后提供潜在的生物标志物。
大量研究表明,癌症(如结直肠癌)、消化系统疾病(如炎症性肠病、肠易激综合征)、神经系统疾病(如自闭症、阿尔茨海默病)、心血管疾病、代谢性疾病(如脂肪肝病、2型糖尿病)、自身免疫疾病(如关节炎、系统性红斑狼疮)等疾病都存在肠道微生物组的改变,如群落结构发生特定变化、特定微生物过度增殖或耗竭。作为健康和疾病的“晴雨表”,疾病相关肠道菌群特征可以通过无创粪便样本检测获取,使得基于肠道微生物组的疾病标志物在疾病的诊断和筛查方面具有潜力。此外,肠道微生物组特征还可与特定疾病的治疗反应和预后相关,如癌症免疫治疗,在预后预测方面也具有应用前景。[1,2]
不同疾病可能存在特异性菌群标志物,也可能有共性的菌群变化。例如,炎症性肠病、2型糖尿病存在一些共性的肠道微生物组变化,反映了两种疾病可能具有共同的致病机制。在癌症领域也有相似发现,癌症患者与看似无关的其他疾病患者存在一些共享的肠道菌群特征,特点是健康相关共生菌与慢性炎症疾病相关共生菌的失衡。鉴定出不同的癌症组织分型具有的共性肿瘤肠道菌群特征,或能为多种癌症类型提供更具成本效益的早期诊断手段。[3,4]
然而疾病的微生物组标志物研究仍存在不一致和矛盾的结果,这可能是因为不同研究使用的研究方法、技术存在差异,也可能与研究样本量和人群异质性(地理、环境、种族、遗传背景等)等因素有关[3]。
近期代表性研究
Ma et al.Nat Med(2018).DOI:10.1038/s41591-018-0164-x
研究分析了广东省内不同地区居民的粪菌样本,揭示出人肠道菌群的地域性,并发现用于代谢性疾病的菌群诊断模型在不同地区难以通用,这种区域化限制在不同疾病也存在差异。
Hyams et al.Lancet(2019).DOI:10.1016/S0140-6736(18)32592-3
研究对约400名溃疡性结肠炎患儿的进行评估发现,可结合临床指标、生物学特征(特定肠道细菌丰度、肠道基因表达等),预测患儿对标准化治疗的应答。
Peled et al.N Engl J Med(2000).doi:10.1056/NEJMoa1900623
一项多国家多中心临床研究分析了1362例接受异体造血细胞移植患者的肠道菌群特征、多样性与临床结局的关系,表明中性粒细胞植入时,较低的菌群多样性与患者死亡风险升高存在显著关联。
Andrews et al.Nat Med(2021).DOI:10.1038/s41591-021-01406-6
通过对77例接受抗CTLA-4、抗PD-1联合免疫检查点阻断治疗(CICB)的晚期黑色素瘤患者的不良事件、血液、肿瘤和肠道菌群进行分析发现,CICB的毒性与肠道菌群有关,特别是拟杆菌的丰度显著增加,肠道菌群通过IL-1β介导肠道毒性。
Derosa et al.Nat Med(2022).DOI:10.1038/S41591-021-01655-5
研究发现粪便菌群Akk菌丰度与预后指标(客观应答率、总生存期)相关,Akk菌的存在与更好的预后相关,但过高的Akk菌丰度(与抗生素使用相关)与较差的预后相关。
Cascone et al.Nat Med(2023).DOI:10.1038/S41591-022-02189-0
研究发现伊匹木单抗可显著增强纳武单抗联合化疗对非小细胞肺癌的主要病理缓解率,治疗反应与肠道微生物组成存在明显关联。
Stein-Thoeringer et al.Nat Med(2023).DOI:10.1038/S41591-023-02234-6
研究发现,没使用高风险抗生素患者的基线肠道菌群特征与治疗结果相关,如长双歧杆菌、肽聚糖合成通路。
相关新闻推荐
2、淀粉芽孢杆菌、枯草芽孢杆菌抑制茄病镰刀菌效果显著,可促进黄瓜幼苗生长(二)
3、鸡白痢沙门菌噬菌体PC79-13生长曲线、生物学特性、基因特征及快速检测法(一)
