ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是由25~35个L-赖氨酸单体通过ε-氨基和α-羧基脱水缩合形成的一种同型氨基酸聚合物。ε-PL具有抑菌范围广、安全无毒和热稳定性高等特点,故广泛用作食品防腐剂,目前已被多个国家使用。
ε-PL的发酵工艺主要为pH控制策略。KAHAR等开创了两阶段pH控制策略,即发酵前期(2 d)将pH控制在5.0以上,获得更高的菌体量;后期将pH控制在4.0左右,快速合成ε-PL。经过连续8 d补料分批发酵,ε-PL产量达到48.3 g/L,成为当时的领先水平。任喜东等建立了一种pH冲击策略发酵生产ε-PL模式。前期控制pH为5.0,随后让pH自然下降,经12 h左右的冲击(pH 3.0)后回调pH值至4.0左右,直至发酵结束。同样经过连续8 d补料分批发酵,ε-PL产量达到54.7 g/L。大量研究表明,发酵过程中将pH控制在4.0左右是S.albulus积累ε-PL的先决条件。目前,关于低pH促进S.albulus高产ε-PL的原因主要有2种观点,第1种观点认为,低pH能够有效的抑制ε-PL降解酶(PL dehydrogenase,Pld)的酶活,防止产生的ε-PL被降解;第2种观点认为,ε-PL合成酶(PL synthetase,Pls)是一种依赖于ATP的非核糖体肽合成酶,低pH环境有利于胞内ATP的积累,从而促进ε-PL的合成。
然而,低pH除了影响Pld酶活和胞内ATP浓度之外,还会对菌体生长速率产生影响,而生长速率的不同又会影响微生物的代谢流分布。王泽建等研究发现:在粪产碱杆菌中,随着比生长速率的升高(0.05 h-1到0.29 h-1),葡萄糖流向菌体生长的比例从18%增加到了47%,流向凝胶多糖合成的碳去向分布由45%降低到了12%;在高比生长速率的情况下,更多的碳源流向菌体的生长以及副产物的生成。那么比生长速率是否也是影响ε-PL合成的一个重要原因呢?目前关于菌体比生长速率对ε-PL合成的影响尚未有研究报道。因此,本研究将通过恒化培养方式,研究不同pH和菌体比生长速率对S.albulusM-Z18合成ε-PL的影响。
pH对S.albulus M-Z18分批发酵的影响
微生物的生长需要一定的酸碱度,链霉菌的最适生长pH为中性偏碱性。pH通过影响微生物细胞膜的电荷、酶活、营养物质和中间代谢产物的解离等进而影响微生物生长和产物合成。pH对S.albulusM-Z18分批发酵结果如图1所示,随着分批发酵进行,pH值由初始6.8逐步下降至pH 5.5(13 h)、pH 5.0(14 h)、pH 4.0(14.5 h)和pH 3.5(15 h),随后依靠自动流加氨水将分批发酵过程控制在不同的pH进行。由图1-a可知,不同pH对S.albulusM-Z18菌体生长产生了显著影响,受控pH越高,发酵结束时菌体量就越高,该实验结果与前期研究保持一致。pH 3.5时,最终生物量为(11.62±0.40)g/L,仅为pH 5.5时的一半[(22.53±0.42 g/L]。另外,在分批发酵分别达到受控pH值后(15 h),μpH 3.5约为0.04 h-1,μpH4.0约为0.07 h-1,μpH 5.0约为0.10 h-1,μpH 5.5约为0.13 h-1(图1-b),表明分批发酵受控pH,pH值越小,S.albulusM-Z18比生长速率越低。然而,ε-PL产量在pH 3.5时最高,达到(5.24±0.10)g/L;当pH高于5.0时,发酵液中检测不到ε-PL(图1-c)。通过对ε-PL比合成速率分析发现,ε-PL快速合成阶段主要集中于18~27 h左右。24 h之后,ε-PL比合成速率显著下降。在大部分时间里,pH 3.5时ε-PL比合成速率高于pH 4.0时(图1-d)。因此,S.albulusM-Z18在低pH环境下积累ε-PL与菌体生长速率存在一定关联。
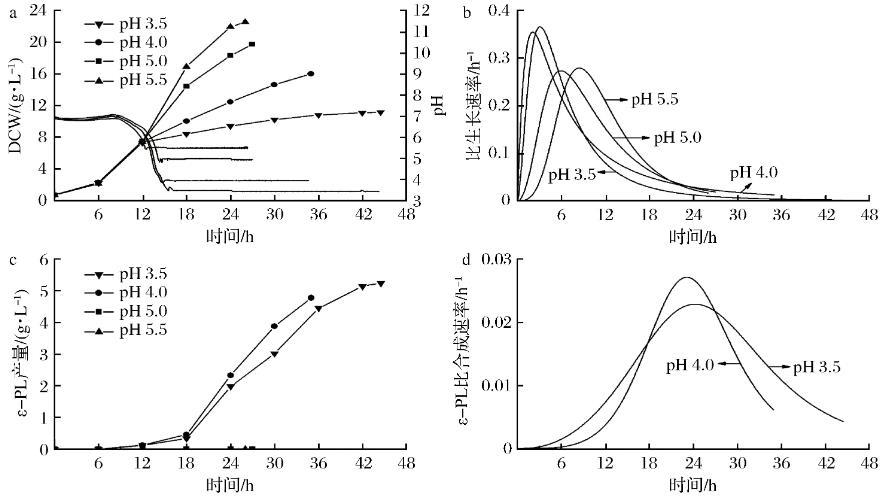
a-菌体生长;b-比生长速率;c-ε-PL产量;d-ε-PL比合成速率图1 pH值对分批发酵过程参数的影响
pH对S.albulus M-Z18恒化培养积累ε-PL的影响
恒化培养可以通过改变稀释率及限制性基质的种类和浓度灵活地控制微生物细胞的比生长速率。通过恒化培养可以使微生物细胞达到“稳态”,故常常被用于微生物生理方面的研究。本文通过控制D=0.04 h-1,研究不同pH(4.0,4.5,5.0)对S.albulusM-Z18合成ε-PL的影响(在稀释率为0.04 h-1时,pH 3.5不能建立恒化体系),如图2a-c所示,随着pH值升高,S.albulusM-Z18生物量逐渐增大,而ε-PL质量浓度逐渐减小。在pH 4.0时,生物量为(8.19±0.05)g/L,ε-PL浓度为(2.43±0.04)g/L;在pH 5.0时,生物量为(12.19±0.14)g/L,ε-PL质量浓度为(0.76±0.02)g/L;在pH 5.5时,生物量为(15.63±0.09)g/L,ε-PL质量浓度为0 g/L。实验结果表明,pH值对于恒化条件下的菌体生长和ε-PL合成影响,与上述分批发酵结果基本一致:低pH有利于ε-PL合成,而不利于菌体生长。进一步动力学参数分析发现,随着pH值降低,细胞得率(YX/S)逐渐减小,葡萄糖比消耗速率(qS)逐渐增大,ε-PL比合成速率(qP)也逐渐增加。特别是在pH 4.0时,YX/S最低(0.376 g/g),qS最高(0.106 g/(g·h)),qP最大(0.012 g/(g·h))(表1)。这表明,低pH时,细胞会快速消耗葡萄糖用于ε-PL的合成。胞内ATP浓度检测发现(图2-d),在pH 4.0时,胞内ATP浓度最高为(7.11±0.80)nmol/mg蛋白,而pH 5.0与pH 5.5胞内ATP浓度分别只有(4.23±0.43)和(2.66±0.70)nmol/mg蛋白。这表明,pH值越低越有利于胞内ATP积累。事实上,ε-PL合成依靠的ε-PL合成酶是一种依赖于ATP浓度的非核糖体肽合成酶,即ATP浓度越高,酶活越高,ε-PL合成速率就越快。另外,已有的研究表明S.albulus中存在2种ε-PL分解酶,它们的最适pH为7.0左右,且酶活会随着pH降低而逐渐减小,在pH 4.0时酶活基本丧失。综上,在菌体比生长速率相同情况下,低pH一方面抑制了分解酶活性,另一方面使得底物葡萄糖更多地用于ATP和ε-PL合成,从而有利于ε-PL积累。
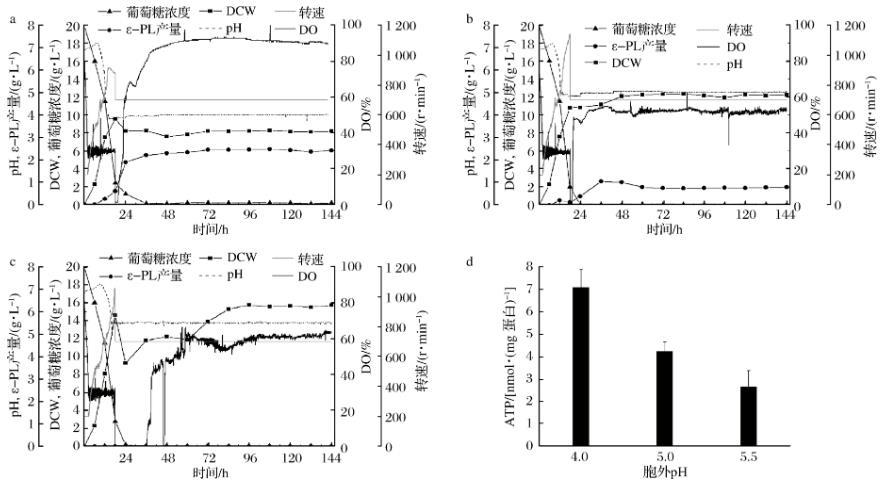
a-pH 4.0;b-pH 5.0;c-pH 5.5;d-胞内ATP含量图2 S.albulus M-Z18在不同pH下的恒化培养(D=0.04 h-1)过程参数和胞内ATP含量
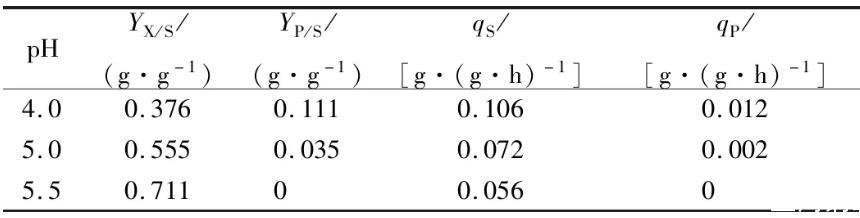
表1不同pH值下S.albulus M-Z18恒化培养(D=0.04 h-1)动力学参数
2.3比生长速率对恒定pH 4.0条件下S.albulus M-Z18合成ε-PL的影响
S.albulusM-Z18在pH 4.0条件下,不同稀释率的恒化培养体系中达到“稳态”时(D=0.08 h-1有轻微洗脱现象),μ=0.04、0.06和0.08 h-1的生物量分别为(8.19±0.05)、(7.83±0.04)和(6.81±0.07)g/L;ε-PL浓度分别为(2.43±0.04)、(2.29±0.06)和(1.68±0.06)g/L(图3a-c)。随着菌体比生长速率的增加(稀释率升高),qS和qP均呈逐渐增加趋势(表2)。相比于D=0.04 h-1、D=0.06 h-1时,qS和qP分别提高了43%和50%;相比于D=0.06 h-1、D=0.08 h-1时,qS提高了70%,而qP只提高了11%。
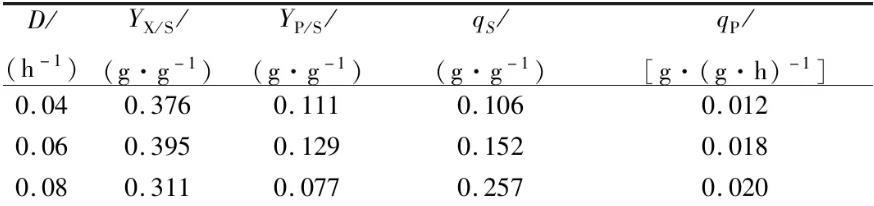
表2不同稀释率S.albulus M-Z18恒化培养(pH 4.0)动力学参数
另外,不同稀释率恒化体系中菌体胞内ATP浓度检测发现,稀释率为0.04、0.06和0.08 h-1时,胞内ATP浓度分别为(7.11±0.80)、(12.98±0.45)和(16.06±1.41)nmol/mg蛋白。相比于D=0.04 h-1、D=0.06 h-1胞内ATP增加了82.5%左右,约6 nmol/mg蛋白。而相比于D=0.06 h-1、D=0.08 h-1胞内ATP仅增加了23.7%,约3 nmol/mg蛋白。综上,在恒定pH 4.0时,菌体比生长速率越高,底物葡萄糖消耗速率、ε-PL比生成速率和胞内ATP浓度就越大,而细胞得率和ε-PL得率(YP/S)却在总体下降。由此可以看出,随着菌体比生长速率提高,底物葡萄糖消耗速率加快,更多的葡萄糖流向了菌体合成和ATP生产,但是ε-PL比生成速率提高不显著,而YP/S下降明显(特别是在D=0.08 h-1时),故过高的菌体比生长速率会降低发酵的经济性。因此,在发酵过程中,除了将pH控制在合适范围内,也需要调节菌体的生长速率保持在合理区间(如0.06 h-1左右),才能实现ε-PL的最高效发酵。
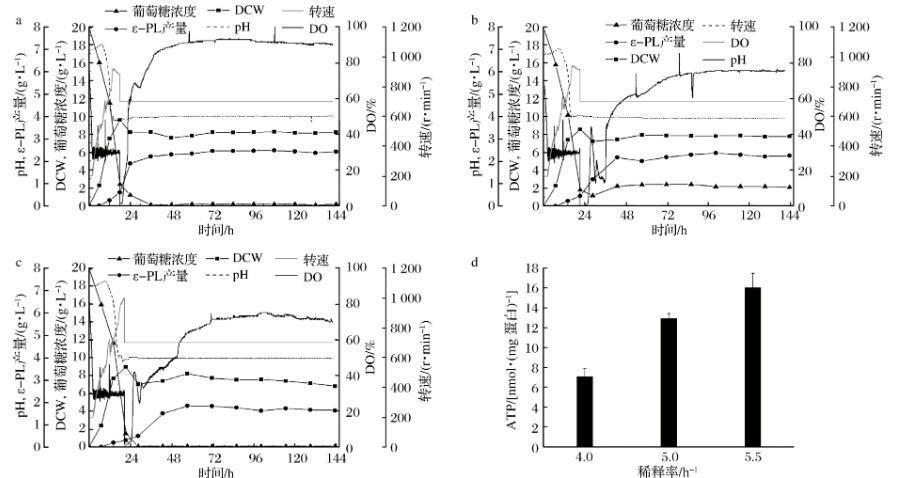
a-0.04 h-1;b-0.06 h-1;c-0.08 h-1;d-胞内ATP含量图3 S.albulus M-Z18在不同稀释率的恒化培养(pH=4.0)过程参数和胞内ATP含量
3结论
为了探究ε-PL发酵过程的关键影响因素,本文从发酵动力学角度,分析了pH值和菌体比生长速率对ε-PL发酵过程参数的影响。研究结果表明,发酵过程控制pH在4.0左右,不仅可以抑制ε-PL分解酶活性,同时使得底物葡萄糖更多地用于ATP和ε-PL合成,从而有利于ε-PL的积累;另外,维持菌体比生长速率在合理区间(0.06 h-1左右),也是获得ε-PL高效积累的重要控制条件。因此,在发酵过程中将pH控制在较低水平,不仅能够抑制分解酶活性、提高胞内ATP浓度,还可以将菌体生长控制在合适的速率范围,最终共同调控了ε-PL大量积累。基于上述发现,在ε-PL补料分批发酵过程中(pH冲击模式),当菌体增长缓慢时,可通过流加有机氮源(如酵母粉)促进菌体生长;而当菌体增长过快,可通过适当下调pH,以维持细胞比生长速率在0.06 h-1左右,进一步达到高产ε-PL的目的。
相关新闻推荐
2、高效降解豆粕碳水化合物和蛋白的菌株筛选及发酵条件优化(二)
