1.3.3 PCR产物的回收
拿出扩增结束Ep管,从中取出5L反应产物,加入1L上样缓冲液,再加入4L的ddH2O混匀。点入预先制备好的1%的琼脂糖凝胶中,120V电泳。在紫外灯下检测扩增结果。切胶到1.5mL的EP管中,称重(不超过200mg),加入600L QG,50℃水浴10min,(如果未完全溶解,要继续水浴,直至完全溶解),每2~3min钟漩涡混匀一次。将溶液转到吸附柱上,12000rmp 1min。倒废液,向吸附柱中加入300 LQG,12000 rmp 1min。倒废液,加入700LPE,室温放置2~5min,12000rmp 1min。倒废液,加入500LPE,室温放置2-5min,12000rmp 1min。倒废液,空柱子12000rmp 2min。将吸附柱转移至无菌EP管中,静置5min挥发残留的PE。向膜中央加入10L的EB,静置3min,12000rmp 2min,扔掉吸附柱,EP管中即为凝胶回收产物。
1.3.4 DNA片段测序
将回收的片段送至生物公司测序,测序引物为16S rDNA通用引物。
1.4砷氧化菌株的生长情况监测:
1.4.1菌株在砷胁迫和无砷胁迫中生长曲线的测定
分别以1%接种量至TSB培养基和1m mol/L As(III)的TSB培养基中摇床培养(37℃,200r/min),每隔2h取样,用紫外分光光度计在OD600测其吸光值。以时间t(h)为横坐标,OD600值为纵坐标,绘制菌株的生长曲线图。
1.4.2菌株对砷的耐受性
在斜面上用接种针取一环菌种至5mL TSB培养基中,摇瓶培养12h(200r/min,30℃)。取下将菌液摇匀,以1%接种量分别接种于含As(III)的TSB试管培养基,置于摇床培养。砷浓度分别是0、1、10、30、35、40、45、50、55、60、65 m mol/L,培养20h,菌株的菌密度值用分光光度计OD600测定。
1.4.3菌株对重金属铜的耐受性
在斜面上用接种针取一环菌种至5mL TSB培养基中,摇瓶培养12h(200r/min,30℃)。取下将菌液摇匀,以1%接种量分别接种于含Cu2+的TSB试管培养基,置于摇床培养。砷浓度分别是0、0.2、0.4、0.7、1.0m mol/L,培养20h,菌株的菌密度值用分光光度计OD600测定。
2结果与分析
2.1筛选砷耐受菌及其砷氧化能力的鉴定:
分离得到并命名为11号菌株对砷氧化能力明显。在含1mM As(Ⅲ)的TSB培养基中培养11号菌,12h后取培养液上清与AgNO3溶液反应,并与As(Ⅴ)/As(Ⅲ)梯度溶液于AgNO3溶液反应对比,发现11号菌株在培养12h后其上清液与AgNO3溶液发生反应后颜色同As(Ⅴ)/As(Ⅲ)梯度溶液100/0接近,可推断出该菌株氧化能力接近100%.
2.2砷氧化菌株16S rRNA基因测序鉴定菌种:
2.2.1 PCR扩增电泳分析
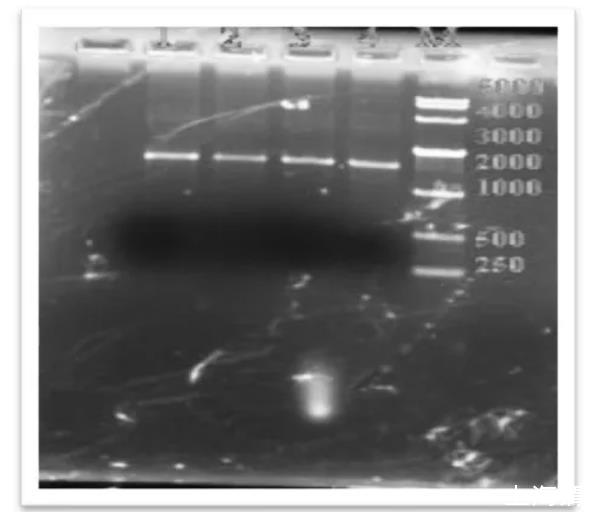
图1泳道1~4为PCR产物,M道为标准核酸分子量MARKER
由图2可以看出,16S rRNA大小为1.5KB左右,图中1~4道电泳条带单一,分子量符合,可以进行下一步测序。
2.2.2菌株16S rRNA基因测序结果:

2.2.3构建进化树:

图2根据11号菌16srRNA测序结果构建进化树
根据上述结果初步确定11号菌属于假单胞菌属(pseudomonas),而已有假单胞菌属被发现有对砷的氧化还原代谢能力。
2.3在砷胁迫下菌株生长曲线测定:
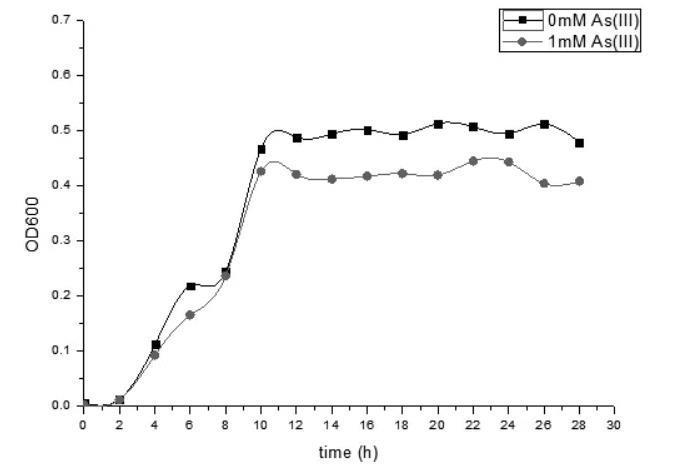
图4可以看出,菌株8 h达到生长的对数期,12~28h达到生长的稳定期。砷的加入并不改变菌体的生长规律,而在砷胁迫下砷对菌体的生长有一定的抑制作用。
2.4菌株对砷的耐受性分析:
含砷量越高,砷对菌的生长抑制越大。当水中As(Ⅲ)达65mM/L时,菌的生长出现了停止,说明菌株对As(Ⅲ)的耐受量为65mM/L.
2.5菌株对铜的耐受性分析:
含铜离子浓度越高,其对菌的生长抑制越大。当水中Cu2+达1mM/L时,菌的生长出现了停止,说明菌株对Cu2+的耐受量1mM/L.
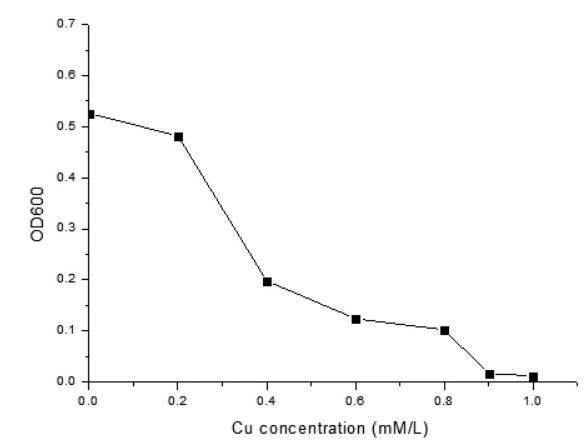
图5菌株对铜的耐受性
3展望
对微生物砷代谢机制的研究发现,微生物的砷甲基化和微生物对砷的氧化作用都可以将As(Ⅲ)转化为毒性较低的有机砷或As(Ⅴ)。如何利用微生物对砷污染环境进行修复已成为国内外关注的焦点,因此生物修复被认为是修复砷污染环境的重要手段。本研究发现的这株砷氧化菌,能在As(Ⅲ)环境下氧化As(Ⅲ)为As(Ⅴ),降低环境中的毒性,同时完成自身的生长。对As(Ⅲ)的耐受量为65mM/L,相较已报道的CLL-B7[10],其耐受性达到CLL-B7的1.5倍,有很高的研究价值。后续将针对其砷环境胁迫中的相关基因表达及重要代谢循环的过程变化研究其对砷的氧化代谢机制。
相关新闻推荐
1、STK1基因对山梨醇高渗胁迫下玉米大斑病菌菌丝生长和发育、致病性的调控机制(三)
