人类胃肠道中有数万亿的微生物(约1012~1014),包括细菌、真菌和病毒,它们参与许多生理功能和疾病发病机制。大量研究证实,肠道菌群在肝硬化的进展中起着至关重要的作用。然而,由于真菌在肠道中的相对丰度较低,真菌对肝硬化的作用往往被忽视。近日,一项发表于Front Microbiol的研究采用16S核糖体RNA测序、内部转录间隔序列测序和非靶向代谢组学技术,以揭示肝硬化患者肠道微生物的特征,并探讨肝硬化患者肠道细菌、真菌及其代谢物的组成和相互作用。
该研究共纳入75名受试者,包括45名失代偿期肝硬化患者(LC组)和30名健康对照者(C组)。LC组受试者血清ALT、TBIL、PT、INR水平升高,WBC、HB、PLT、ALB、PTA水平下降(P<0.05)。LC组受试者的中位CTP评分为5,MELD评分为9。病因分布为HBV/HCV感染25例,酒精性肝病(ALD)10例,代谢相关性脂肪性肝病(MAFLD)5例,自身免疫性肝病(AIH)5例。
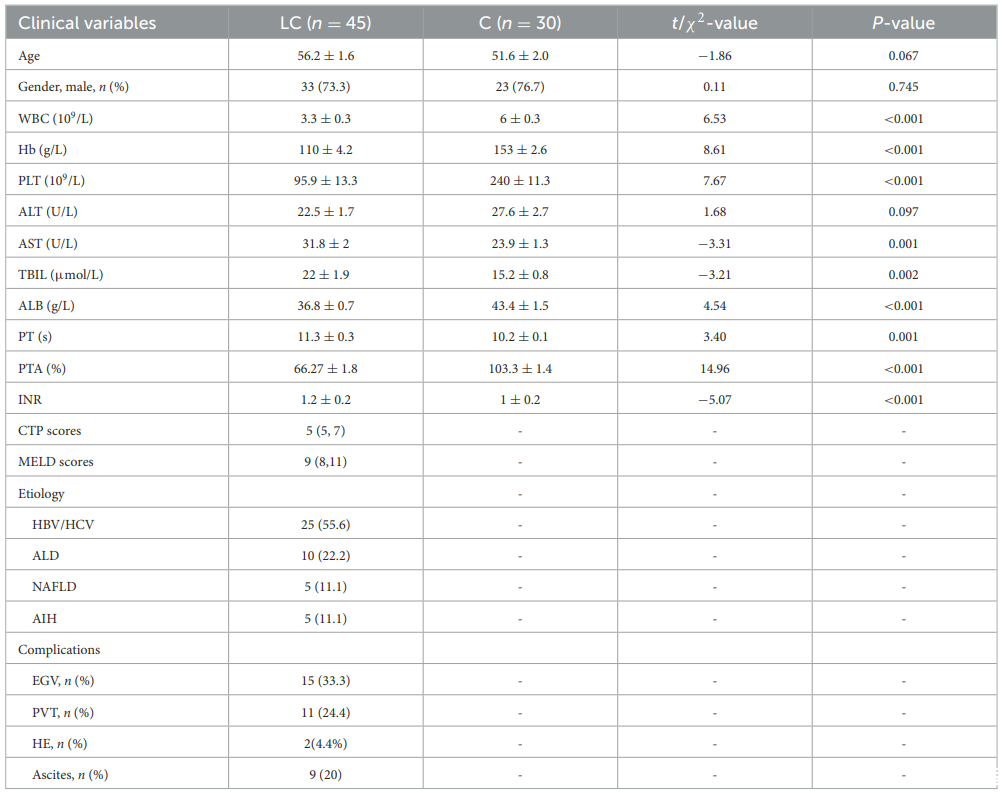
表1.受试者基线特征(源自文献)
肠道微生物组和真菌组的特征
01肠道细菌从LC组和C组粪便样本中共获得10 274 244条高质量16S rRNA序列,最终获得6 861个ASVs。基于Shannon指数,LC组的α多样性显著低于C组(P<0.01,图1A)。基于Bray-Curtis距离的β多样性分析(PCoA)结果显示,LC组的肠道细菌群落结构与C组存在显著差异(P=0.001,图1B)。
LC组和C组的主要细菌门均为厚壁菌门(Firmicutes)(图1C)。在属水平上,粪球菌属(Faecalibacterium)、布劳特菌属(Blautia)和双歧杆菌属(Bifidobacterium)是平均相对丰度最高的三个属(图1D)。随后,研究者进一步确定了组间丰度存在显著差异的细菌属(图1E)。LC组中,链球菌属(Streptococcus)、阿克曼菌属(Akkermansia)、乳酸乳球菌属(Lactobacillus)和假肠杆菌属(Pseudomonas)显著富集,而Blautia、厌氧丁酸菌属(Anaerobutyricum)、Gemmiger、瘤胃球菌属(Ruminococcus)和Dorea则显著减少。
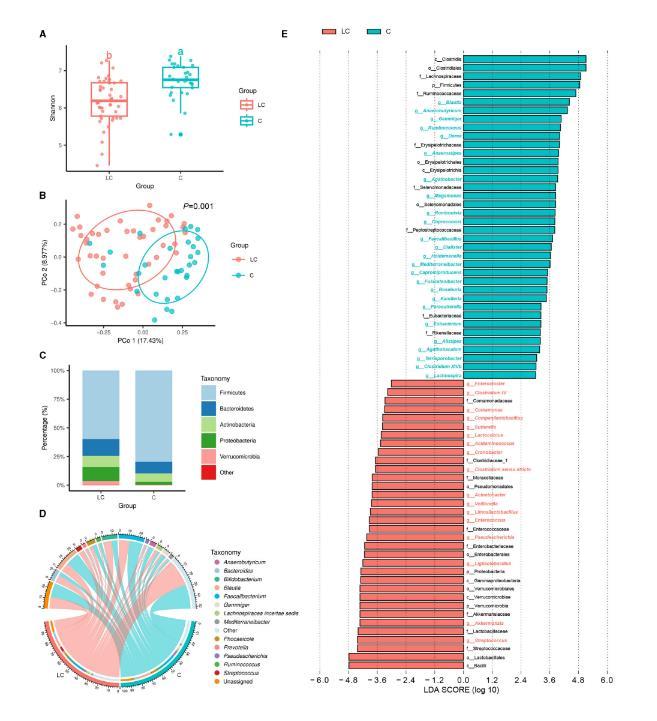
图1.受试者肠道细菌群落特征(源自文献)02肠道真菌从LC组和C组粪便样本中共获得9 594 331条高质量ITS rRNA序列,最终获得901个ASVs。基于Shannon指数,LC组的α多样性也显著低于C组(P<0.01,图2A)。基于Bray-Curtis距离的PCoA结果显示,LC组的肠道真菌群落结构与C组存在显著差异(P=0.004,图2B)。
LC组和C组的主要真菌门均为子囊菌门(Ascomycota)(图2C)。在属水平上,酿酒酵母属(Saccharomyces)、假丝酵母属(Candida)和曲霉属(Aspergillus)是平均相对丰度最高的三个属(图2D)。进一步分析表明,LC组中酿酒酵母属显著增加,而曲霉属、青霉属(Penicillium)、木耳属(Auricularia)和枝孢霉属(Cladosporium)显著减少。
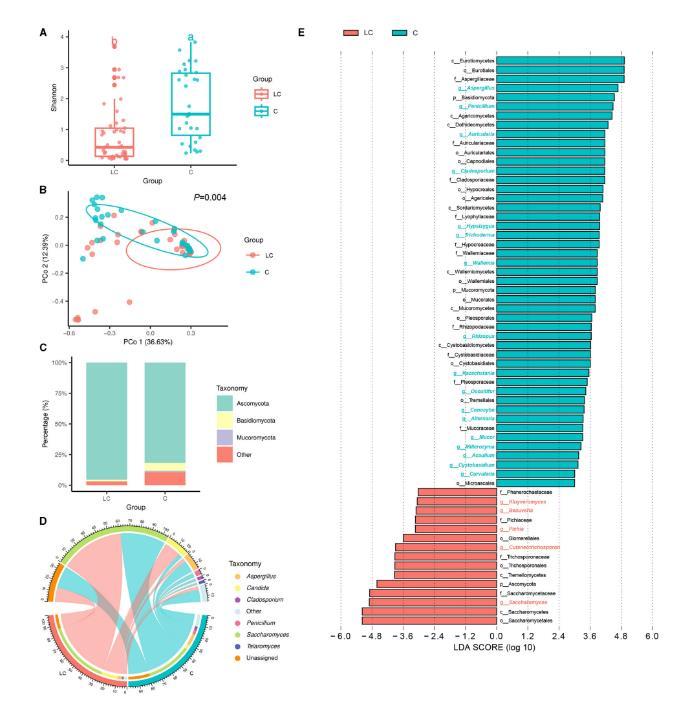
图2.受试者肠道真菌群落特征(源自文献)
肠道代谢组特征
基于非靶向代谢组学技术,研究者从LC组和C组粪便样本中检测到11 382个变量,其中LC组富集了727个变量,C组富集了814个变量(图3A)。研究者最终确定了130种差异代谢物,其中LC组富集了68种,C组富集了62种。LC组中显著富集的代谢物包括5,6-二氢杨梅素、甘草次酸、胆红素等(图3B)。差异代谢物主要参与卟啉代谢、脂肪酸代谢等通路,其中卟啉代谢通路在LC组中显著富集。
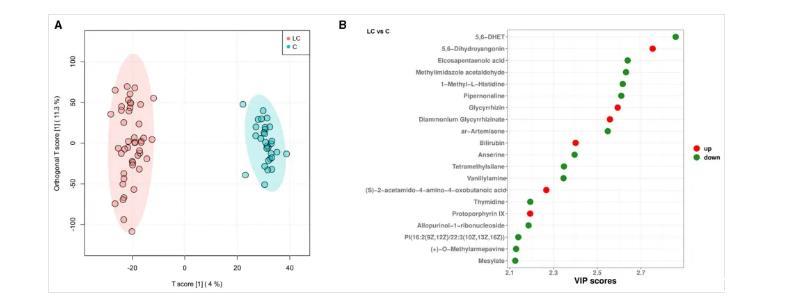
图3.受试者肠道代谢物的特征(源自文献)
内镜治疗对肠道微生物组和代谢物的影响
01细菌和真菌变化研究者对15名接受内镜治疗的LC组受试者治疗前后的粪便样本进行分析,发现内镜治疗对肠道细菌和真菌的多样性和群落结构无显著影响,但部分细菌属和真菌属的相对丰度发生变化,如不动杆菌属(Acinetobacter)增加,巨单胞菌属(Megamonas)减少;Cutaneotrichosporon减少。
02代谢物变化内镜治疗后,受试者体内代谢物组成发生显著变化,其中诺龙(nandrolone)在治疗后组富集,而治疗前的组富集了15种代谢物。差异代谢物主要参与丁酸代谢途径。
多组学整合分析与诊断模型构建
LC组受试者的临床指标(如ALB、HGB、MELD、PLT等)与肠道细菌、真菌和代谢物之间存在显著相关性。并且LC组中,细菌属、真菌属和富集代谢物之间存在复杂的相互作用网络,其中细菌与代谢物之间的联系更为紧密。
研究者基于16S数据、ITS数据、代谢物数据、临床指标及其组合构建的随机森林模型用于区分LC组受试者和C组受试者。最后,研究者基于不同特征(细菌、真菌、代谢物、临床指标)构建了一个肝硬化诊断模型,其AUC值为0.938。
该研究揭示了肝硬化患者肠道微生物组成的特征及其复杂的内部串扰,为探索肠道微生物在肝硬化中的潜在作用提供了启发。
相关新闻推荐
1、类肠膜魏斯氏菌对猪生长性能、粪菌和代谢产物的影响——结果与分析
