2结果与分析
2.1类肠膜魏斯氏菌对猪生长性能的影响
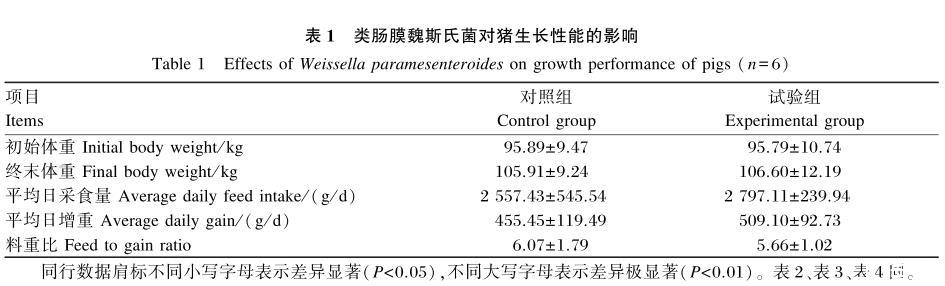
如表1所示,试验组猪的平均日增重和平均日采食量均高于对照组,料重比低于对照组,但差异均不显著(P>0.05)。
2.2类肠膜魏斯氏菌对猪粪菌的影响
2.2.1α多样性分析
按照97%的相似度聚类后,2组样品获得1 119个操作分类单元(OTU),聚类为16个门,22个纲,37个目,68个科,206个属,361个种。如表2所示,2组的α多样性指数均无显著差异(P>0.05),但对照组的α多样性指数较试验组高。
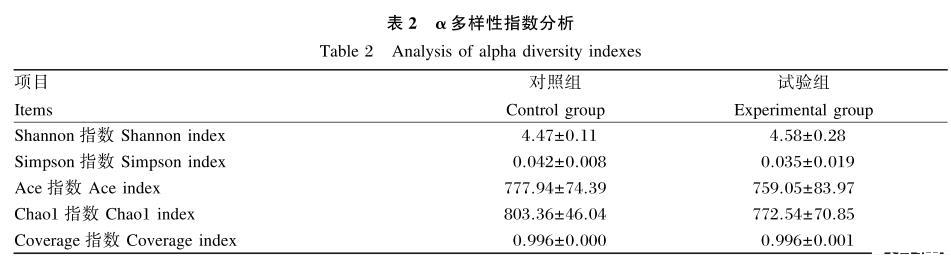
表2α多样性指数分析
2.2.2β多样性分析
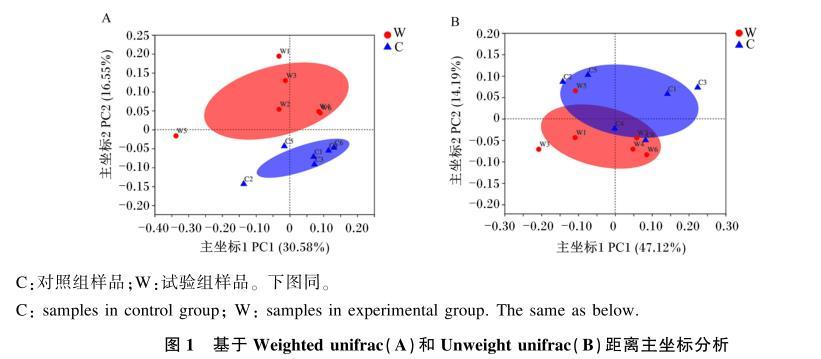
通过Weighted Unifrac(图1-A)和Unweight unifrac(图1-B)的加权距离主坐标对试验数据进行分析。图1-A中2组的样品完全分开,说明当综合主要物种的种类和相对丰度等因素进行分析时,添加类肠膜魏斯氏菌后,粪菌结构中主要部分发生显著变化。图1-B中2组样品未完全分开,部分重叠,说明当忽略物种的相对丰度,而综合物种的多样性和物种间的进化关系进行分析时,2组样品既有相似部分,又有不同部分,添加类肠膜魏斯氏菌对粪菌中相对丰度较小的菌影响较小。综上所述,饲粮中添加类肠膜魏斯氏菌后,猪的粪菌中优势菌群组成发生了改变。
2.2.3基于门水平的菌群结构分析
如表3所示,2组样品主要聚类在3个门:厚壁菌门、拟杆菌门和螺旋体门。结果显示,与对照组相比,添加类肠膜魏斯氏菌极显著提高了螺旋体门相对丰度(P<0.01),显著提高了变形菌门相对丰度(P<0.05);提高了厚壁菌门/拟杆菌门的比值,但差异不显著(P>0.05);降低了拟杆菌门的相对丰度,但差异不显著(P>0.05)。
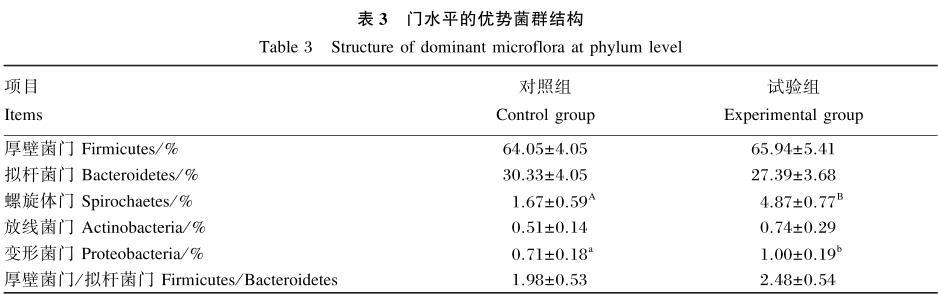
表3门水平的优势菌群结构
2.2.4基于属水平的菌群结构分析
如表4所示,2组中的相对丰度最高的菌属均为链球菌属。试验组的狭义梭菌属_1(P<0.05)和密螺旋体属_2(P<0.01)的相对丰度显著或极显著高于对照组,Norank_f_F082和瘤胃球菌科_UCG-002相对丰度则显著低于对照组(P<0.05)。
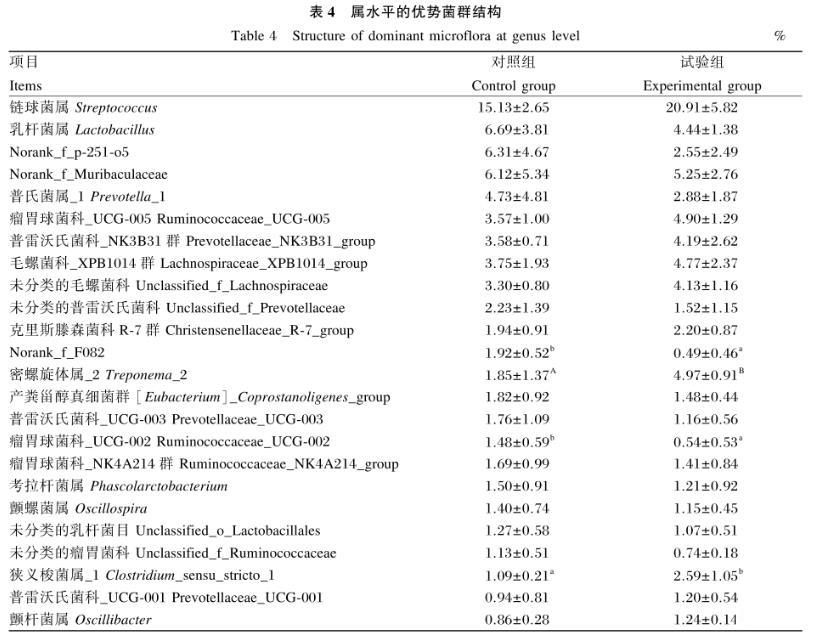
表4属水平的优势菌群结构
2.2.5群落组成差异分析
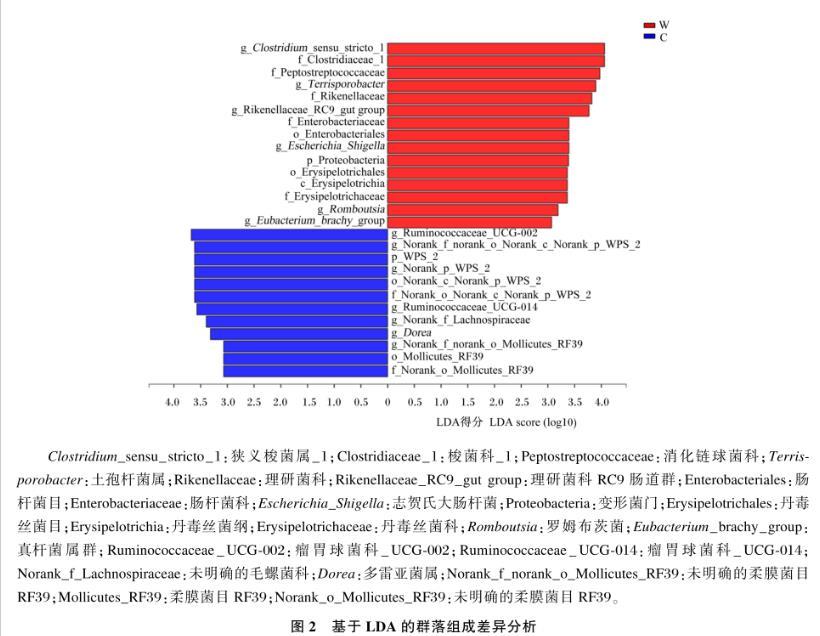
采用LEfSe研究添加类肠膜魏斯氏菌后对猪粪菌群结构的影响,结果如图2所示。LDA值>3.0时,2组共获得27个生物标记物,其中试验组获得15个生物标记物。对照组LDA值最大的是瘤胃球菌科_UCG-002,试验组的是狭义梭菌属_1。纲水平上,试验组中丹毒丝菌纲相对丰度高于对照组,Norank-p-WPS-2的相对丰度则低于对照组。属水平上,试验组的狭义梭菌属_1、土孢菌属、理研菌科RC9肠道群、志贺氏大肠杆菌和真杆菌属相对丰度高于对照组,瘤胃球菌科_UCG-002、WPS-2、瘤胃球菌科_UCG-014、未分类的毛螺菌科、多雷亚菌属和未明确的柔膜菌目RF39的相对丰度则低于对照组。
2.3差异代谢产物分析
2.3.1 PLS-DA
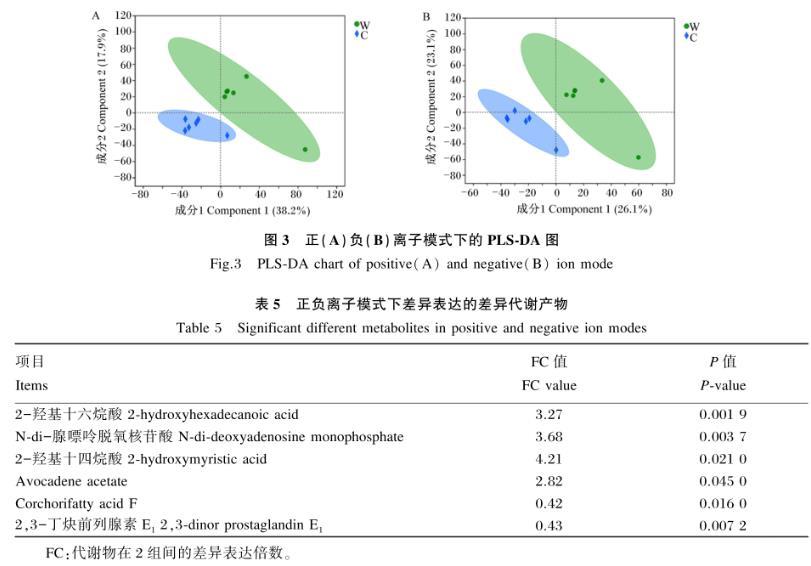
本研究采用判别分析的直观展示分类效果较好的PLS-DA方法对差异代谢产物进行分析。如图3所示,2种模式下(正负离子),2组样品完全分开且分离度较大,说明饲粮中添加类肠膜魏斯氏菌后,猪粪便中代谢物的组成发生了改变。
2.3.2代谢物注释
本研究采用非靶向代谢组学方法对样本中的差异代谢产物进行分析。采用倍数变化法即根据代谢物的绝对定量结果,计算某个代谢物在2组间表达量的差异表达倍数(FC)值。当差异表达倍数大于2.5或者小于0.45,P值小于0.05时,差异代谢产物结果见表5。与对照组相比,添加类肠膜魏斯氏菌后,试验组中2-羟基十六烷酸(P<0.01)、磷酸脱氧腺苷(P<0.01)、2-羟基十四烷酸(P<0.05)和Avocadene acetate(P<0.05)差异表达倍数显著或极显著上调,Corchorifatty acid F(P<0.05)和2,3-丁炔前列腺素E1(P<0.01)差异表达倍数显著或极显著下调,其中2-羟基十四烷酸和Corchorifatty acid F分别是上调和下调差异表达倍数最高的代谢产物,脂肪酸类物质如2-羟基十六烷酸和2-羟基十四烷酸差异表达倍数均极显著上调(P<0.01),2,3-丁炔前列腺素E1差异表达倍数极显著下调(P<0.01)。
2.3.3关联分析
本研究采用将差异代谢产物和差异菌群关联性分析(图4)。饲粮中添加类肠膜魏斯氏菌后,狭义梭菌属_1和土孢杆菌属相对丰度与Corchorifatty acid F差异表达倍数呈显著负相关(P<0.05),狭义梭菌属_1和理研菌科RC9肠道群相对丰度与2-羟基十六烷酸差异表达倍数呈极显著正相关(P<0.01),土孢杆菌属相对丰度与N-di-腺嘌呤脱氧核苷酸差异表达倍数呈显著负相关(P<0.05),瘤胃球菌科_UCG-002相对丰度与2-羟基十六烷酸(P<0.05)和N-di-腺嘌呤脱氧核苷酸差异表达倍数(P<0.01)呈显著或极显著负相关。
相关新闻推荐
1、肠出血性大肠杆菌O157:H7的生物膜形成和生长曲线分析
