2.结果
2.1异羟肟酸抑制细胞生长
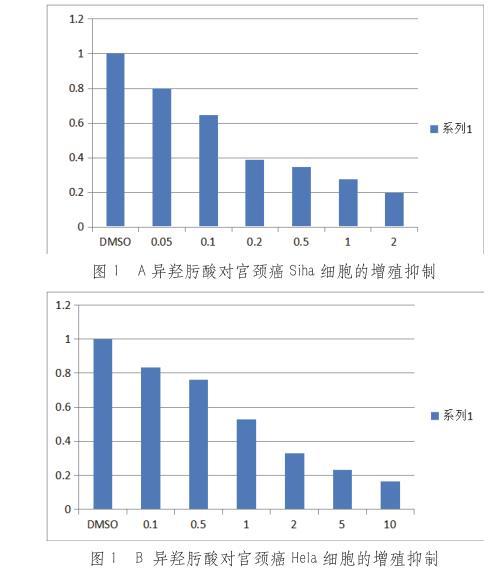
MTT检测结果显示,异羟肟酸显著抑制Hela和Siha细胞生长,呈时间和浓度依赖性(见图1A、1B)。不同浓度(0~5 mmol/L)SAHA处理Hela和Siha细胞可抑制细胞生长,差异有统计学意义(F=4.87,P<0.01);SAHA处理不同时间(0 h~96 h)可抑制细胞生长,差异有统计学意义(F=3.78,P<0.01)。经直线回归方程计算,异羟肟酸作用48、72、96 h时IC50值分别为14.08、6.78、4.25 mmol/L。
2.2异羟肟酸对细胞周期的抑制


异羟肟酸可显著影响宫颈癌Hela和Siha细胞的周期分布,使Hela和Siha细胞G0/G1期比例显著增加(P=0.001)(见表1)。异羟肟酸降低Hela细胞S期(P=0.052)和G2/M期(P=0.059)比例,但差异无显著性。异羟肟酸降低Siha细胞S期(P=0.004)和G2/M期(P=0.007)比例,差异有显著性。
2.3异羟肟酸上调p53表达
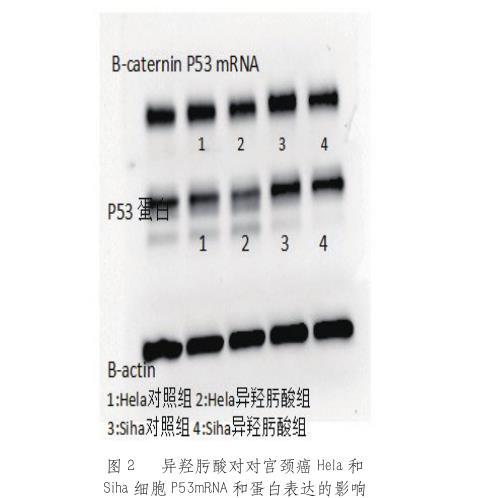
RT-PCR检测显示异羟肟酸上调Hela和Siha细胞的p53mRNA表达。Westernblot检测提示异羟肟酸促进Hela和Siha细胞的p53蛋白表达(见图2)。
3.讨论
现有大量研究表明,癌症的发生与表观遗传学有着密切的关系,主要包括组蛋白乙酰化、磷酸化、泛素化及DNA甲基化等,其在基因转录调节中起着重要的作用。Zhang Y等在2004年发现组蛋白脱乙酰酶抑制剂能增强人鳞癌细胞放疗的敏感性。为了进行基因表达,细胞必须在组蛋白周围调控DNA的螺旋和非螺旋,而这一过程需在组蛋白乙酰化酶的协助下方能完成,故HDAC抑制剂可引起组蛋白超乙酰化,从而影响细胞的基因表达。HDACs不仅仅能够催化组蛋白的去乙酰化,而且能够催化其他一些重要蛋白(如Hsp90、Tubulin等)和转录因子(p53、STAT1等)的乙酰化.HDAC在基因转录中起重要作用;其可与某些转录因子(如E2F、Stat3、p53、NF-_B、TFIIE及Rb蛋白)发生相互作用,从而调节基因转录。
研究表明p53蛋白羧基端乙酰化能抑制乙酰化赖氨酸与泛素酶的结合并由此引起的降解,而这种单泛素化降解能促进p53蛋白的核转运。因此p53羧基端乙酰化可稳定p53在核内停滞并影响其在线粒体中的功能表达。同时,在正常情况下,乙酰化p53在细胞中的比例很低。反映出在体内具有强去乙酰化作用。早期研究显示在多种肿瘤细胞中,p53羧基端乙酰化状态能调节转录凋亡前效应。
Xing J等研究不同浓度SAHA联合顺铂(DDP)治疗人类宫颈癌SiHa细胞,抑制和细胞凋亡率和细胞周期。SiHa细胞处理后20%的IC50SAHA24小时,经历了各种剂量的辐射处理。S发现AHA在化疗时通过上调p21和Bax促进SiHa信使rna和蛋白质的细胞凋亡,导致细胞周期阻滞于G0/G1期。低剂量的SAHA在放疗时通过Bax上调和Ku70下调促进SiHa细胞凋亡和抑制细胞修复。
本研究证实异羟肟酸抑制人宫颈癌Hela和Siha细胞生长,可呈药物依赖性地抑制细胞增殖、诱导细胞凋亡。阻滞于G0-G1期的细胞明显增多,P53水平显著上升。异羟肟酸使Hela和Siha细胞G0/G1期细胞比例显著增加,推测异羟肟酸主要通过影响细胞周期,使细胞阻滞于G0/G1期,从而抑制宫颈癌细胞生长。我们观察到,异羟肟酸对Hela细胞的生长抑制强于对Siha细胞的生长抑制。这可能因为Hela细胞G0/G1期比例明显低于Siha细胞,Hela细胞中有更多细胞处于S期和G2/M期,推测异羟肟酸可能对增殖旺盛细胞的生长抑制作用更强。在宫颈癌细胞株中,HDAC抑制剂可经P53途径诱导肿瘤细胞凋亡。HDAC抑制剂可增加P53的转录,上调P53基因的表达,阻止P53蛋白被E6降解。本实验中观察到异羟肟酸上调p53表达,引起G0/G1期阻滞,可见细胞凋亡。
新型HDAC抑制剂在小剂量、低氧浓度情况下可诱导肿瘤细胞分化、选择性凋亡。HDAC抑制剂作为一种新型的靶向抗癌药,正成为药物研究的新热点,临床应用前景广泛。这类抑制剂可以靶向性地使肿瘤细胞出现生长停滞、分化、凋亡,对正常细胞无毒性,而且其抗肿瘤谱广,实用性较强,临床潜力巨大。
