我国肉与肉制品产量巨大,2021年人均肉类消费量达到了23.9 kg,产业发展势头迅猛。肉品具有较高的水分活度和适宜的pH,极易被微生物污染引起腐败变质。在肉品加工、储存和零售过程中,微生物是导致肉品腐败的主要原因,每年给肉类行业造成数十亿美元的经济损失。因此,防止或延缓肉品腐败是全球食品行业共同关注的问题,也是近年来食品科学领域的研究热点。
芽孢杆菌作为食品中常见的优势腐败菌,广泛地存在于在各类食品中。国内外关于芽孢杆菌的研究较多,对芽孢杆菌的形态、分类等已有较为透彻的研究,研究证明芽孢杆菌是肉制品中的优势腐败菌之一。对狮子头中腐败菌进行菌群结构分析,发现芽孢杆菌在三个处理组中所占的丰度值为20%左右,是狮子头腐败过程中的主要优势菌。甯雨荞等在分离市售笋子烧牛肉中的腐败菌时发现枯草芽孢杆菌的致腐能力最强。同时,芽孢杆菌还具有较强的抗逆性,传统的巴氏杀菌很难将其杀灭,在后续合适的环境条件下会迅速繁殖,造成食品腐败变质。WEBB等综述了蜡样芽孢杆菌在低温食品中的危害,杨啸吟等进一步论述了不同包装的冷却肉腐败过程中挥发性气体与芽孢杆菌等腐败菌之间的关联,再次表明芽孢杆菌是导致肉类腐败的主要细菌。目前针对芽孢杆菌的研究已证明其为低温肉制品中腐败能力较强的腐败菌,但缺乏对于肉源性芽孢杆菌不同菌株之间腐败性能异质性的研究。本研究认为,分析不同芽孢杆菌之间腐败性能的差异,是研发针对性防控芽孢杆菌污染技术的基础。
在微生物污染之后,肉品常见的腐败特征包括产酸、产气和发粘等,这是由微生物多种内源酶的氧化分解作用引起的。为了探究不同芽孢杆菌在肉品腐败中的主要致腐特性,根据肉品腐败特征,本研究拟探索6株肉源性芽孢杆菌的产酸、产气、腐败酶等特性,为后续进行肉制品中芽孢杆菌针对性防控提供理论基础。
1.材料与方法
1.1材料与仪器
试验所用的6株芽孢杆菌均由南京农业大学国家肉品质量安全控制工程技术研究中心提供,分离自低温香肠,具体见表1;LB营养琼脂、LB肉汤、玉米油(脂酶)细菌微量生化鉴定管、可溶性淀粉琼脂、卢戈氏碘液等均购于青岛海博生物技术有限公司;干酪素购于北京索莱宝科技有限公司;磷酸二氢钠、磷酸氢二钠均购于国药集团化学试剂有限公司;无水乙醇、95%乙醇均购于上海麦克林生化科技有限公司。
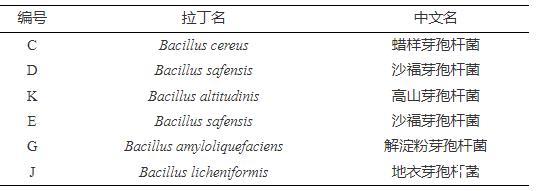
表1 6株芽孢杆菌信息
BIOⅡAdcance4 Sterile GARD生物安全柜西班牙Telstar公司;Scan1200自动影像分析菌落计数仪法国Interscience公司;DRP-9162型电热恒温培养箱上海森信实验仪器有限公司;SQL1010C立式压力蒸汽灭菌器日本Yamato公司;涡旋振荡器美国Scilogex公司;Testo 205便携式pH计德国Testo公司;M2e酶标仪美国MD公司;PD500匀浆机英国PRIMASCI公司;MUL-9000系列超纯水系统美国Milli-Q公司。
1.2实验方法
1.2.1菌株活化
将6株在−80℃冷冻保存的芽孢杆菌于室温下进行解冻,用接种环沾取菌液在LB营养琼脂平板上划线,在36±1℃培养24 h后将单菌落挑入LB肉汤中,于36±1℃培养24 h,完成第一次液体扩培;取200µL扩培菌液移入至新的LB肉汤,于36±1℃培养24 h,完成第二次活化,备用。
1.2.2基本特性
1.2.2.1生长曲线测定
取0.2 mL活化菌液接种至5 mL的LB肉汤中,分别放在20℃和37℃温度条件下培养24 h,每3 h取样测定600 nm下的吸光度。
1.2.2.2产酸能力测定
取0.5 mL活化后的菌液接种至5 mL的LB肉汤中,放置于20℃和37℃下培养,在第0、6、12、24、36、48 h取样,8000×g离心5 min,取上清测量pH,结果以不添加菌株的LB肉汤的空白组上清pH数值减去测试菌株的上清pH数值表示。
1.2.2.3产气能力测定
在玻璃试管中注入5 mL的LB肉汤并放入Durham管,接种菌液前保证Durham管内无气泡,取0.8 mL活化后的菌液接种至灭菌后的玻璃试管中,用橡胶塞密封;将所有的玻璃试管置于37℃环境中培养,在第12、24、36、48和72 h测量Durham管中的气柱高度。
1.2.3腐败酶
1.2.3.1蛋白酶活力测定
液体法测蛋白酶参照国标《GB/T 23527-2009蛋白酶制剂》中提供的福林法并稍作改良。
活化后的菌液用8500×g离心5 min,上清即为粗酶液。样品组每管加入0.1 mL酪蛋白溶液,空白组每管加入0.2 mL三氯乙酸溶液,于40±0.2℃的温度下孵育10 min后用福林溶液显色,待显色完全,在680 nm测定吸光度。制作蛋白酶液体法标准曲线,得出浓度与吸光度之间的拟合公式为Y=0.0053X−0.0024,拟合度R2>0.99,拟合程度较好。根据标准曲线计算出最终的酶活,单位为U/mL。
固体法测蛋白酶活力通过观察菌落在乳粉琼脂平板和熟鸡肉琼脂平板(cooked-chicken juice agar,CJA)上呈现出的分解圈大小,确定蛋白酶活力强弱。乳粉琼脂平板制法参考ELEGBELEYE等方法;CJA平板参考王光宇的生鸡肉琼脂平板(raw-chicken juice agar,RJA)法并改进。
乳粉琼脂平板:分别配制15%脱脂牛奶和LB营养琼脂培养基,分开灭菌后以1:9的比例混匀,倒入无菌培养皿制成乳粉琼脂平板。
CJA:将熟制后的鸡胸肉与0.1 mol/L磷酸盐缓冲液(PBS,pH6.2)以1:40(W/V)的比例匀浆(6000×g,3 min);匀浆液过滤后将滤液与等体积的3%琼脂溶液充分混合,灭菌完成后倒入无菌培养皿制成熟鸡肉琼脂平板。
取活化好的菌液5µL滴加到乳粉琼脂平板和CJA上,分别放置于20℃和37℃下培养。每24 h观察记录菌落生长情况和分解圈形成。
1.2.3.2脂肪酶活力测定
取活化后的菌液,向脂酶细菌微量生化鉴定管注入10µL菌液,注入菌液时尽量使菌液流过鉴定管内的培养基斜面,充分与指示剂混合后用封口膜密封生化鉴定管。按照试剂盒说明书,将鉴定管置于37℃培养48 h,并与空白组对比,观察颜色变化。
1.2.3.3淀粉酶活力测定
取活化菌液5µL滴加到淀粉琼脂平板上,分别放置于20℃和37℃下培养。每24 h取样,用卢戈氏碘液染色,观察记录菌落生长情况和分解圈形成。
1.3数据处理
试验数据采用Microsoft office软件进行数据整理,每个指标重复3次,采用平均值±标准差形式表示;分解圈面积采用Image J软件进行计算;用IBM SPSS Statistics 2进行统计分析,采用最小显著差数测验法(LSD)检验不同处理组之间的显著性水平(P<0.05),采用Origin2019b作图。
相关新闻推荐
1、绘制OD值生长曲线,判断细菌生长阶段的核心方法【附操作要点】
