1.2试验方法
1.2.1重组质粒pT-UL2-RFP构建
重组质粒pT-UL2-GFP-gpt用限制性内切酶NheI-HF、BamH I-HF双酶切,切除重组质粒GFP-gpt表达盒,回收6.2 kb片段,质粒pT-RFPNX用限制性内切酶NheI-HF、BamH I-HF双酶切,回收大小为711 bp RFP片段,通过T4 DNA连接酶将RFP替换GFP-gpt,构建重组质粒pT-UL2-RFP。
1.2.2重组病毒的制备、纯化
DEV细胞适应毒接种CEF(MOI=0.01),吸附1~2 h后,按Lipofectamine 3000说明书转染高纯度质粒pT-UL2-RFP。转染后72~96 h,观察细胞病变情况,待80%细胞产生病变后,反复冻融3次,接种于新鲜CEF单层的六孔培养板中,用含5%血清、1%双抗、1%琼脂的M199培养液覆盖,37℃、5%CO2培养箱中培养48~72 h。观察荧光,挑取单个有红色荧光的蚀斑,在细胞上重复多次传代,直至所有的蚀斑都带有红色荧光,确定为纯化的重组病毒。
1.2.3重组病毒基因组DNA的提取
取重组DEV病毒液437.5μL,加入蛋白酶K(20 mg/mL)12.5μL,10%SDS 50μL;56℃水浴1 h;分别用酚/氯仿/异戊醇(25∶24∶1)、氯仿各抽提一次;取上清,加入1/10体积3 mol/L醋酸钠和两倍体积的无水乙醇,-20℃放置30 min;12000 g离心10 min,去除上清后,70%乙醇洗涤沉淀一次,沉淀溶于30μL去离子水中,-20℃保存备用。
1.2.4重组病毒鉴定重组病毒DNA用鉴定
引物ORFC17F、ORFC17R进行PCR扩增,PCR产物送北京华大基因生物公司测序。
1.2.5一步生长曲线
将重组病毒及其亲本毒分别接种于8瓶25 cm2(MOI=0.01)的CEF中,接种后每隔12 h取出一瓶接毒细胞,收集细胞培养液上清作为上清样品,再加入1 mL含有1%FBS的M199细胞维持液,冻融后取上清作为细胞样品。将重组病毒及亲本毒的病毒悬液做10倍系列稀释,取4个适宜稀释度,接种新鲜的CEF单层96孔细胞培养板,每孔接0.1 mL,每个稀释度接5孔,37℃吸附1 h后每孔加入0.1 mL细胞维持液,37℃、5%CO2培养箱中培养5 d。观察致细胞病变效应(Cytopathic Effect,CPE),记录每个稀释度出现CPE的孔数,按Reed-Muench法计算病毒TCID50,并绘制一步生长曲线。
1.2.6重组病毒的稳定性
将重组病毒接种CEF(MOI=0.01),待80%细胞产生病变后,反复冻融3次,再接种CEF,按此方法连续传代12次。荧光显微镜下观察每代重组病毒的红色荧光表达情况。按1.2.3方法提取第5代、第10代、第12代病毒DNA,用鉴定引物ORFC17F、ORFC17R通过PCR鉴定外源基因RFP是否稳定存在。PCR产物送北京华大基因公司进行测序。
2结果与分析
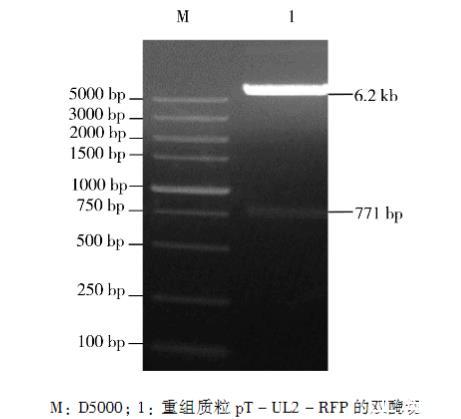
2.1重组质粒pT-UL2-RFP的酶切鉴定
重组质粒pT-UL2-RFP用限制性内切酶NheI-HF以及BamH I-HF双酶切鉴定,得到大小约为6.2 kb和771 bp的两个片段(图1),符合理论值。