1.4.3不同培养条件下的生长曲线的测定
取纯化后的细菌液体培养,菌液浓度达到1×108~5×108CFU/mL。取200μL的菌液和20 mL添加5%牛血清的THB液体培养基于锥形瓶中,在不同培养温度(25、37、42℃)、培养基pH值(4~9)、盐浓度(1%~5%)条件下测定0、2、4、6、8、10、12、14 h菌液OD600nm值,绘制生长曲线。
1.4.4常用消毒剂中和剂的筛选
将0.5%碘伏的中和剂设为0.5%硫代硫酸钠+1%卵磷脂+1%吐温80和0.5%硫代硫酸钠+1%卵磷脂+3%吐温80;0.2%新洁尔灭中和剂设为1%卵磷脂+1%吐温80和1%卵磷脂+2%吐温80;1 000 mg/L的84消毒液中和剂设为5%硫代硫酸钠+1%卵磷脂+1%吐温80和1%硫代硫酸钠+2%卵磷脂+3%吐温80;5%来苏水中和剂设为3%吐温80[16]。参照《消毒技术规范》[17],设置6个试验组,分别为:消毒剂+菌悬液、消毒剂+菌悬液、中和剂+菌悬液、消毒剂+中和剂+菌液、稀释液+菌悬液(阳性对照)、稀释液+中和剂+培养基(阴性对照)。试验结果需符合第1组无菌生长,或仅有极少数分离株菌落生长;第2组有菌落生长,且较第1组为多,但较第3,4,5组少;第3~5组有相似量试验菌生长,其组间菌落数误差率应不超过15%;第6组无菌生长[18]。
1.4.5常用消毒剂对驴源马链球菌马亚种杀菌率的检测
取0.5 mL菌悬液、0.5 mL 3%牛血清白蛋白加入试管,混匀,置20℃水浴5 min后,加入不同浓度消毒液4.0 mL注入其中,迅速混匀并立即计时。至各预定时间后分别吸取0.5 mL混合液加于4.5 mL中和剂,混匀。作用10 min后,吸取1.0 mL混合液,按平板计数方法测定存活菌数,每管混合液接种2个培养基。阳性对照组用稀释液代替消毒剂溶液,所得结果代表菌液原有浓度。消毒剂试验设计见表1。消毒剂杀菌率的计算公式如下:
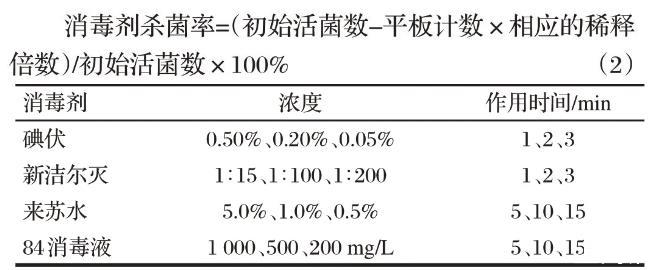
表1消毒剂试验分组
2结果与分析
2.1病原菌分离纯化及生化特性
从发病驴和死亡驴的下颌脓汁和死亡驴肺部脓汁共分离到4株菌,XJ201901为死亡驴下颌脓汁分离,XJ201902为死亡驴肺部分离,XJ201903和XJ201904为发病驴下颌脓汁分离。
由图1可知,4株菌均为革兰氏阳性,长链状球菌,β溶血。

图1分离菌镜检及血平板培养情况
由表2可知,4株分离菌生化鉴定结果均为马链球菌马亚种,置信度94%。

表2分离株生化鉴定结果
2.2 PCR鉴定结果
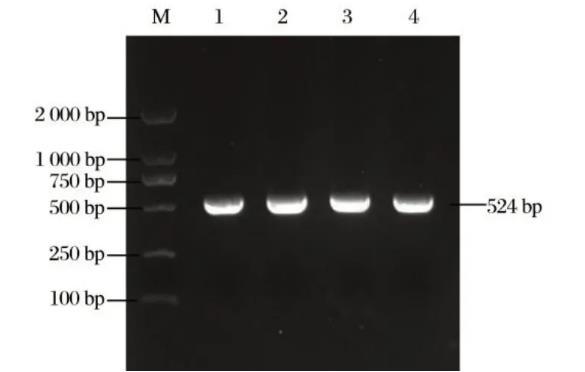
图2 seM基因PCR鉴定
4株分离菌提取基因组DNA后,用seM基因特异性引物扩增seM基因片段。由图2可知,扩增产物经核酸电泳后可观察到1条长约542 bp的片段,经过测序对比分析,结果显示其序列与NCBI中登录的驴源马链球菌马亚种seM基因序列(MH973488.1)同源性均超过99%,说明4株分离菌株均为马链球菌马亚种。
2.3分离菌株不同培养条件下的生长特性(见图3~图5)
由图3可知,4株分离菌在不同温度下生长情况明显不同,37℃条件下细菌生长迅速,4 h进入对数期并在8 h达到高峰,菌量可达108CFU/mL,8~14 h基本处于平台期。25℃条件下细菌生长缓慢,培养10 h后才有明显生长。42℃条件下,分离株比37℃早一步进入对数期,在6 h达到高峰,但总菌量低于37℃,平台期维持时间较短,8 h之后快速进入衰亡期。
图3不同温度条件下4株分离菌生长曲线
由图4可知,4株分离菌在4%及5%盐浓度时不生长。1%和2%盐浓度4 h进入对数期,8~12 h处于平台期,12 h后细菌开始衰亡,生长趋势一致,但是2%盐浓度下细菌总量低于1%盐浓度3%盐浓度条件下细菌生长缓慢12~14 h才达到其最大值。

图4不同盐浓度条件下4株分离菌生长曲线
由图5可知,4株分离菌在pH值为4、5、9时不生长;pH值为7、8时,细菌生长情况基本一致;但pH值为8条件下,细菌在衰亡期的下降要快于pH值为7的条件;pH值为6时,细菌生长缓慢,菌量始终显著低于pH值7、8。
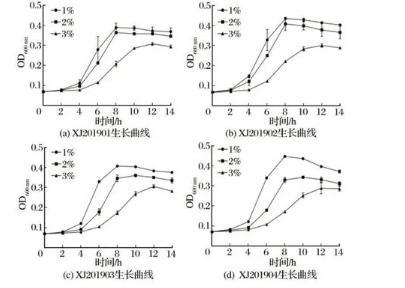
图5不同pH值条件下4株分离菌生长曲线
相关新闻推荐
1、EcSF工具预测发酵生肉香肠加工和储存过程中产志贺毒素大肠杆菌的浓度(四)
2、定向梯度驯化酿酒酵母W303-1A在糠醛和对羟基苯甲酸抑制胁迫下生长情况(一)
