1.2植物和细菌培养
将番茄种子于55℃水浴中浸泡催芽,待种子出芽之后播种至穴盘中,将草炭∶蛭石∶珍珠岩以3∶1∶1的比例均匀混合为培养基质。将穴盘放于恒温光照培养箱中进行培养,培养条件为:25℃恒温光照12 h,18℃恒温黑暗12 h。待幼苗长至2叶1心后,移苗至盆中放于恒温光照培养箱中培养。幼苗长至5叶1心后选取长势相当的健康植株用于试验。
将Pto接种至含有利福平(50μg/mL)的KB固体培养基中;将cor-接种至含有卡那霉素(100μg/mL)和利福平(50μg/mL)的KB固体培养基中。平板倒置于28℃恒温培养箱中,培养14~16 h。
1.3番茄叶片的COR处理
将COR溶解配置为1μmol/L(高浓度)、0.1μmol/L(较高浓度)、0.01μmol/L(较低浓度)、0.001μmol/L(低浓度)4个浓度的COR溶液,选取第3、4片复叶中较大的5片小叶进行处理,用1 mL无菌注射器(去注射器针头)将不同浓度COR溶液注射进番茄叶片中,每片小叶注射溶液量约为1 mL,以去离子水作为对照组,每个组至少处理15片小叶。24 h后取样,用液氮速冻叶片之后存放于-80℃冰箱中用于后续实验。
1.4基因表达差异分析
将COR处理后的番茄叶片于液氮中研磨至粉末状,取100 mg混合均匀的样品,采用Trizol法提取总RNA。利用反转录试剂盒将总RNA反转录得到cDNA。利用Primer 5设计7对引物(表1),测定不同处理下叶片中的PR1a、LoxD、MYC2、EIN2、EIN3和PAL5基因的相对表达量,以番茄Actin基因作为内参基因。在CFX96实时荧光定量分析仪(Bio-Rad上海有限公司)上进行RT-qPCR反应。反应程序为:95℃预变性30 s,反应循环“95℃变性5 s,60℃退火延伸30 s”,共设置40个循环。采用2-ΔΔCt法计算基因相对表达量。本次试验设置3次生物学重复。
1.5细菌生长能力测定
用10 mmol/L MgCl2溶液将KB固体培养基上活化培养的细菌菌落重悬,稀释菌液直至OD600=0.2。将OD600=0.2的菌液(浓度为1×108CFU/mL)稀释1 000倍,用1 mL无菌注射器注射菌液到叶片中,每片小叶注射菌液量约为1 mL,72 h后用打孔器随机在接种过细菌的叶片上打孔取样,每个处理取9个叶圆片,用研磨仪研磨叶片,梯度稀释菌液之后取10μL菌液滴于KB固体培养基上,待菌液自然挥发之后倒置于28℃培养箱中进行培养48 h。选取CFU(Colony-Forming Units)在20~100范围内的梯度进行计数,每个梯度至少3次计数后取平均值计数。本实验设置3次生物学重复。
1.6胼胝质沉积分析
用1 mL无菌注射器注射OD600=0.2的菌液到叶片中,每片小叶注射菌液量约为1 mL,以10 mmol/LMgCl2溶液作为对照。以水∶甘油∶苯酚∶乳酸∶乙醇=1∶1∶1∶1∶2的体积比配置脱色液,胼胝质是一种相对较晚的植物防御指标,在接种细菌到叶片15 h后能够在叶片中被观测到,我们将处理15 h后的叶片浸没在脱色液中过夜脱色。用去离子水和50%乙醇交替冲洗叶片3次,采用0.01%水溶性苯胺蓝将叶片胼胝质染色,染色时间为30 min。染色结束后用去离子水洗去叶片上的染液,移到载玻片后制成叶片标本放于荧光显微镜紫外波长下观察,保存图像。采用Image J软件统计胼胝质沉积数量。每个处理组取至少取5片叶片进行观察,每片叶片至少选取3个不同视野区域进行统计。本实验设置3次生物学重复。
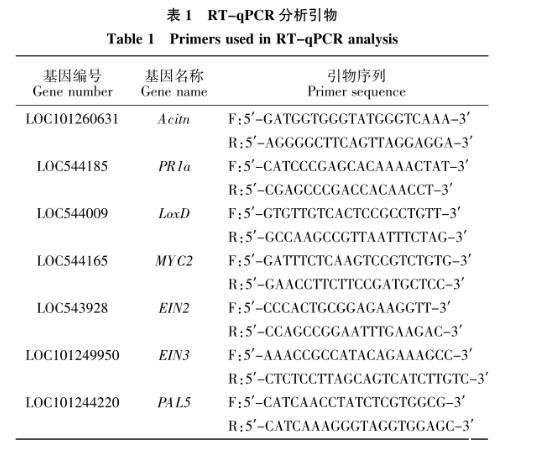
表1 RT-qPCR分析引物
1.7数据处理
使用IBM SPSS Statistic 20进行差异显著分析,采用Excel软件绘图。
