建立了仔猪副伤寒活疫苗生产用菌株生长曲线,获取菌株培养参数,从而实现合成培养基初步应用。将猪霍乱沙门氏菌(CVCC79500株)运用试管和三角瓶分别静置和振荡培养30 h,期间取4、8、12、18、24、30 h等6个点进行活菌计数并建立生长曲线,确定37℃静置培养18~24 h,37℃、200 r/min振荡培养8~24 h为培养稳定期。不同接菌量比较结果表明,37℃静置培养24 h,37℃、200 r/min振荡培养12 h均可达到菌体稳定期。在稳定期参数条件下,比较合成培养基与常规普通肉汤培养基对该菌的增殖效果,结果表明,37℃静置培养24 h,试管及三角瓶培养菌数分别为27×108~31×108、33×108~41×108CFU/mL;37℃、200 r/min振荡培养12 h,试管及三角瓶培养菌数分别为58×108~66×108、78×108~88×108CFU/mL。而同条件3批普通肉汤培养菌数均低于合成培养基,且批次间稳定性较合成培养基差。将合成培养基振荡培养12 h的菌液接种小鼠均10/10存活;免疫后攻毒家兔达4/5~5/5保护,与普通肉汤基本一致。合成培养基保存期试验表明,25℃避光保存28 d与当天配制的液体合成培养基,振荡培养菌数基本一致。获取的培养参数适合用于合成培养基的初步评价,研制的合成培养基培养菌数优于普通肉汤,且不影响菌体安全性及免疫原性,室温保存期可达28 d。
接种仔猪副伤寒活疫苗(C500株)是预防和控制猪霍乱沙门氏菌病的有效途径[1-2]。但制苗用菌液生产一直采用的是普通肉汤,其主要成分牛肉汤易受动物的种类、年龄、肉源的新鲜度及消化程度的影响,造成疫苗批次间的质量不稳定[3-4]。而合成培养基由于其成分相对确定且质量稳定,是解决培养批次间稳定性差的关键,并逐渐成为国内外研究的热点[4]。不过,如何实现大量合成培养基的筛选研制是广大科研工作者面临的难题。通过建立仔猪副伤寒活疫苗生产用菌株生长曲线,了解该菌株的生长规律,选择其对数生长末期或稳定期的培养参数和培养菌数作为参考,通过在同培养条件下,筛选较高培养菌数的培养基是实现合成培养基研制的重要途径之一[5]。
对于小型实验室和兽用生物制品企业,试管和三角瓶是日常最常用的培养器具。而静置培养和振荡培养,因其操作简便、需要仪器设备简单,广泛用于生产用种子液制备及科学研究中大规模发酵工艺生产的前期小试。一直以来,我国现行兽用生物制品规程(2000版)(以下简称《规程》[3])虽规定仔猪副伤寒制苗用生产种子采用37℃静置培养24 h,但缺少完整的培养参数。而对于三角瓶振荡培养(也称摇瓶发酵培养),因其体积小,培养基需求量小,模拟了发酵培养的换气频率和溶氧环境,虽已广泛用于实验室中培养基筛选、大规模发酵培养前的小试,但对于仔猪副伤寒活疫苗生产用菌株的培养参数的几无报道,这为日常菌液培养冻干、基因组及质料提取、新型合成培养基筛选研究带来困难。
本研究运用试管及三角瓶进行猪霍乱沙门氏菌(CVCC79500株)系统的静置和振荡培养试验,确定了该菌的生长曲线,通过选择菌数稳定期的培养参数条件,从而实现在同条件下对研制的合成培养基进行初步应用评价,为开展细菌合成培养基的研究提供经验方法和借鉴思路。
1材料
1.1菌种生产用菌种为猪霍乱沙门氏菌(CVCC79500株)(2006.8.29冻干,0.3 mL/支);检验用菌种为猪霍乱沙门氏菌(CVCC79102株)(2006.8.29冻干,0.3 mL/支),由中国兽医药品监察所鉴定、保管和供应。
1.2试剂及耗材仔猪副伤寒活疫苗合成培养基(批号为200701、200702、200703),由北京中海生物科技有限公司配制及提供。其主要成分:胰酪蛋白胨(批号VM732731-644),购自MERCK公司;酵母浸粉(批号911948)购自OXOID公司;磷酸二氢钾、磷酸氢二钠、氯化钠、葡萄糖等均为分析纯化学试剂,购自北京化学试剂公司。
普通肉汤(批号为20070130、20070115、20070122及20070205),由中国兽医药品监察培养基组配制和供应。
A型试管,规格:25 mL;三角瓶,规格:500 mL,由中国兽医药品监察培养基组购自北京化工玻璃厂。
1.3仪器37℃恒温培养箱及HZL-250恒温双层振荡培养箱,江苏太仓市实验设备厂。
1.4动物小鼠:ICR系,30~35日龄、体重18~22 g,清洁级;大耳白兔:体重1.5~2.0 kg,普通级;由中国兽医药品监察所实验动物组采购并提供。
2方法
2.1种子液制备按《规程》[3]方法进行。
2.2生长曲线的建立
2.2.1静置培养将普通肉汤分别分装于6支25 mL A型试管(分装10 mL/管)和1瓶500 mL三角瓶(分装200 mL/瓶),按2%接入种子液,37℃静置培养30 h,期间分别于4、8、12、18、24、30 h取出1管样品及从三角瓶中取样5 mL,按现行《中国兽药典》[6]方法进行活菌计数。
2.2.2振荡培养普通肉汤按2.2.1项方法分装,按2%接入种子液,37℃、200 r/min振荡培养30 h,期间分别于4、8、12、18、24、30 h取出1管样品及从三角瓶中取样5 mL,按现行《中国兽药典》[6]方法进行活菌计数。
2.2.3不同接种菌数的比较研究种子液按《规程》[3]制备500 mL,以3500 r/min离心20 min,弃上清,菌泥用60 mL的灭菌生理盐水悬浮,然后分别稀释成每4 mL含20×108、40×108、80×108、160×108、320×108CFU活菌。
将普通肉汤按200 mL/瓶分装10瓶500 mL三角瓶,2%接入种子液(每瓶4 mL),接入菌数分别为20×108、40×108、80×108、160×108、320×108CFU,其中5瓶37℃静置培养24 h,另5瓶置37℃、200 r/min振荡培养12 h,期间分别取37℃静置培养18、24 h,37℃振荡培养8、12 h样品各5 mL,按现行《中国兽药典》[6]方法进行活菌计数。
2.3合成培养基的初步应用
2.3.1研制的合成培养基与常规培养基的比较
2.3.1.1培养菌数运用已建立的仔猪副伤寒活疫苗生产用菌株培养参数,制备3批合成培养基(批号分别为200701、200702及200703)与3批普通肉汤培养基(批号分别为20070115、20070122及20070205),各分装于A型试管(10 mL/管)和500 mL三角瓶(200 mL/瓶)中。按2.2项建立的培养参数,按2%加入种子液,37℃静置培养24 h和37℃、200 r/min振荡培养12 h,分别取样进行活菌计数。
2.3.1.2培养菌体的安全性及免疫原性将三角瓶中每批合成培养基培养的菌液,3500 r/min离心20 min,弃上清,菌体沉淀用适量生理盐水悬浮后,进行活菌计数。分别皮下注射体重18~22 g的小鼠10只,0.2 mL/只(含1×108CFU活菌),观察21 d,记录存活情况;肌肉注射体重1.5~2.0 kg的家兔5只,1.0 mL/只(含25×108CFU活菌),30 d后,连同条件相同的不免疫对照家兔5只,各皮下注射经肉肝胃(膜)消化汤培养2代的猪霍乱沙门氏菌(CVCC79102株)1.0 mL(含3 MLD的活菌),观察30 d,记录存活情况。2.3.2合成培养基保存期将3批合成培养基分别按说明书用注射用水配制成5000 mL溶液,116℃灭菌30 min,置室温(25℃)避光保存0、7、14、21、28 d。然后分装于灭菌的500 mL三角瓶中(培养基装量200 mL),各按2%加入种子液,37℃、200 r/min振荡培养8、10、12 h,分别取样进行活菌计数。
3结果与分析
3.1静置及振荡培养结果见表1。从表1看出,静置培养,A管与三角瓶菌数变化趋势一致,18~24 h可达到菌数稳定期;振荡培养,A管与三角瓶菌数变化趋势基本一致,8~12 h可达到菌数稳定期。

表1猪霍乱沙门氏菌(CVCC79500株)培养计数结果(单位:×108CFU/mL)
注:种子液活菌计数为8.3×108CFU/mL。
3.2不同接种菌数的比较从表2看出,接入菌数多,其培养到达稳定期时间提前,而接入菌数少,其培养到达稳定期时间慢,但37℃静置培养24 h、37℃、200 r/min振荡培养12 h均各自达到菌数稳定期。

表2不同接种菌数猪霍乱沙门氏菌(CVCC79500株)培养计数结果(单位:×108CFU/mL)
3.3合成培养基与普通肉汤的比较试验结果见表3、表4。从表3结果看出,在相同培养条件下,3批合成培养基的培养菌数均较3批普通肉汤的培养菌数高。从表4结果看出,合成培养基培养的菌体对小鼠安全,均10/10健活;免疫效果与普通肉汤结果基本一致,免疫兔达4/5~5/5保护,对照5/5死亡。

表3培养基比较试验结果(单位:×108CFU/mL)
200701批与20070115批接入活菌计数为9.2×108CFU/mL种子液、200702批与20070122批接入活菌计数为11×108CFU/mL种子液、200703批与20070205批接入活菌计数为11×108CFU/mL种子液
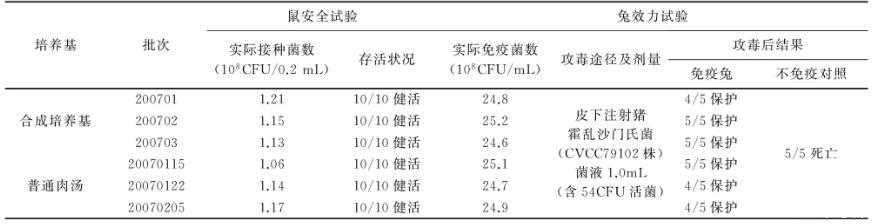
表4培养菌体安全及免疫原性试验结果
注:因《规程》[3]中无“效力检验”方法,“效力试验”参考《规程》[3]中“免疫原性试验”进行。
3.4保存期结果从表5显示,合成培养基室温(25℃)保存28 d的培养菌数与保存当日基本一致。
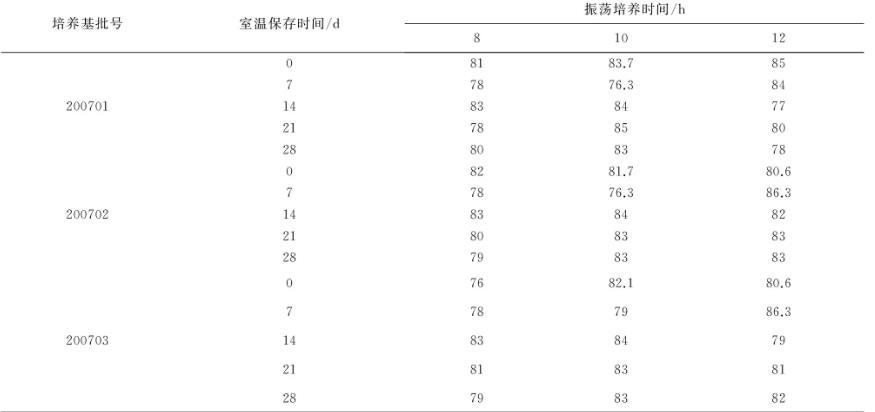
表5培养基不同保存期活菌计数结果(单位:×108CFU/mL)
注:200701批接种菌液为11.3×108CFU/mL;200702批接种菌液为10.1×108CFU/mL;200703批接种菌液为9.5×108CFU/mL
4小结与讨论
细菌在液体培养基中生长繁殖,可分为迟缓期、对数期、稳定期和衰亡期[2]。通常需要选择对数生长末期或稳定期的细菌,用于进一步的冷冻、提取基因组、培养基筛选等试验[4,7]。静置与振荡培养是常规试验的两种培养方法,但因为振荡培养的溶氧和换气频率远高于静置培养,因而两者培养所达到的细菌含量以及到达稳定期的时间不同,从而能从表1中得出静置和振荡培养菌数差异大。
运用试管及三角瓶以静置和振荡培养建立的生长曲线,发现培养基只要按容器体积的标准盛装量(体积的1/3~1/2),在培养主要参数一致的情况下,如振荡培养时试管与三角瓶均采用透气塞、均垂直置于摇床中,并采用同样的温度、转速、接菌比例、培养时间,其培养趋势基本一致。但由于容器及内部空间体积不一样,三角瓶溶氧含量高于试管,因而三角瓶培养菌数高于试管。而对于静置培养,试管与三角瓶均采用透气塞,温度及接菌比例一致,其培养趋势基本一致,而且培养菌数与容器无关,仅与培养方式有关。
不同接菌量的种子液比较试验发现,接入菌数多,培养到达稳定期时间提前,而接入菌数少,到达稳定期时间慢。按照表2中设计的接菌量,如果按静置培养20×108CFU/mL计,则20×108~320×108CFU/mL相对于含200 mL培养基的三角瓶中接菌量达0.5%~8%。由于我国兽用生物制品种子液一般都采用静置培养,因而表2接入菌数所占比例完全能覆盖兽用生物制品种子液常用的1%~3%接菌量[3],表明按此标准的接菌量对整个振荡培养中培养菌数影响不大。
由生长曲线获得的细菌培养参数,在此参数下可得出研制的合成培养基批次间相对稳定,培养菌数优于普通肉汤。由于牛肉汤难以质量标准化,因此3批普通肉汤培养菌数差异大[3-4]。同时运用合成培养基培养的菌体对小鼠的安全检验及对家兔的免疫攻毒结果与普通肉汤一致,符合《规程》[3]中“仔猪副伤寒活疫苗制造及检验规程”的要求。另外合成培养基保存28 d,其培养菌数与当天新配制培养基一致。因此,初步试验表明,研制的合成培养基质量稳定,培养菌数高,而且不改变菌体的安全性及免疫原性,可替代普通肉汤。当然,合成培养基在发酵生产中的实用性有待进一步研究。
本文采用实验室最常用的培养器具(试管和三角瓶),首次系统建立了静置和振荡培养仔猪副伤寒活疫苗生产用菌株的生长曲线。明确了37℃静置培养24 h或37℃、200 r/min振荡培养12 h,可获得培养菌体稳定期。在此参数下,初步完成了培养基的比较筛选和应用评价。上述工作的完成,为我国兽用细菌类疫苗合成培养基的筛选研究提供了经验借鉴,从而进一步为实现兽用细菌类疫苗高密度培养工艺化改造奠定基础。
相关新闻推荐
1、全自动生长曲线分析仪应用-胰腺肿瘤细菌的生存机制及其代谢化疗药物的能力(一)
3、江米酒曲中高产凝乳酶菌筛选、生长曲线及凝乳活力及蛋白水解活力测定(四)
