2.3解淀粉芽孢杆菌GSBa-1的生长和产酶活力曲线图
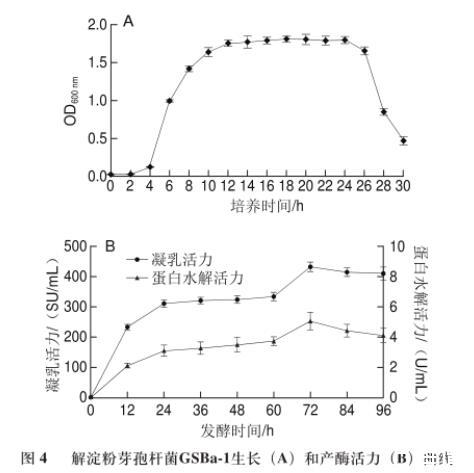
图4解淀粉芽孢杆菌GSBa-1生长(A)和产酶活力(B)曲线
由图4A可知,OD600nm值显示菌株LB-51在液体培养基中0~4 h生长速率缓慢,菌体生物量几乎不增加,处于迟缓期;在4~12 h时生长速率最快,菌体细胞以几何级数速率分裂,处于对数生长期;在12~24 h时菌体量随时间变化不大,基本保持平衡,处于稳定期;24 h以后菌体量迅速减少,菌体死亡速率超过新生的速率,处于衰亡期,一般是由于营养成分不足和后期代谢产物的增加导致环境变化引起的。由图4B可知,菌株GSBa-1产凝乳酶在其对数生长期内产量很少,随着发酵时间延长,产酶量也逐渐增加,在24~60 h之间产酶增加量不明显;但随着时间继续延长,产酶活力明显提高,在72 h时达到最大值,凝乳活力为(431.53±15.89)SU/mL,同时蛋白水解活力为(5.05±0.59)U/mL;之后酶活力逐渐降低,蛋白水解活力与凝乳活力变化趋势基本相同。
2.4解淀粉芽孢杆菌GSBa-1凝乳酶的凝乳活性评价

图5解淀粉芽孢杆菌GSBa-1凝乳酶、凝乳反应和乳清析出
由图5A可知,菌株GSBa-1凝乳酶粗酶为浅灰色,蓬松棉絮状。由图5B可知,相同的酶质量浓度条件下,GSBa-1凝乳酶比商业酶凝乳反应时间稍长,凝块结实且富有弹性。由图5C可知,凝块收缩且都伴有乳清析出现象,和商业酶相比,菌株GSBa-1凝乳酶乳清析出反应不明显。在凝乳反应中,2 mg/mL GSBa-1凝乳酶液凝乳时间为78 s,即凝乳活力为307.69 SU/mL,菌株GSBa-1粗酶单位酶活力为1.54×105SU/g;相同质量浓度条件下商业凝乳酶凝乳时间为36 s,单位酶活力为3.16×105SU/g。
3讨论与结论
从传统安全食品宫廷奶酪的凝乳剂(江米酒酒曲)中分离筛选产凝乳酶的优良菌株对发掘传统饮食文化遗产、丰富产凝乳酶微生物菌源和缓解干酪加工所需凝乳酶紧张的供应状态有着重要的理论和实践意义。国内已初步开展了酒曲中产凝乳酶微生物的分离筛选。刘振民等采用酒药作为分离源,筛选出高产凝乳酶霉菌菌株M10,并对该菌发酵产酶条件进行了优化研究。滕国新等对酒曲中产凝乳酶微生物进行了分离纯化研究,结果表明根霉菌为酒曲中产凝乳酶优势菌。程巧玲等从酒曲中筛选得到一株霉菌、一株酵母菌和两株细菌,并确定霉菌为产凝乳酶优势菌。本实验借鉴前人的研究经验,通过对酒曲中微生物的分离纯化,共得到11株细菌和2株真菌;采用酪蛋白平板法初筛和不同液体培养基发酵复筛出一株产凝乳酶优势菌株LB-51。根据形态学观察、生理生化实验和16S rDNA分子生物学鉴定该菌株为解淀粉芽孢杆菌,并命名为解淀粉芽孢杆菌GSBa-1。此实验结果表明酒曲中存在高产凝乳酶细菌菌株,与前人报道的霉菌是产凝乳酶优势菌株不一致,这可能与酒曲来源及种类有关。
液体LB培养基作为实验菌株GSBa-1适宜的发酵产凝乳酶培养基,该菌株在此培养基中发酵产凝乳酶的凝乳活力于72 h时达到最大值,为(431.53±15.89)SU/mL,且蛋白水解活力为(5.05±0.59)U/mL。凝乳酶的C/P值(凝乳活力与蛋白水解活力的比值)是干酪加工中凝固剂的一个重要的效率指标。有研究表明凝乳酶的C/P值在100~200之间时,凝乳效果最佳,本实验菌株GSBa-1所产凝乳酶的C/P值为85.45,与上述比值接近,说明该实验菌株所产凝乳酶适用于干酪的加工。将该菌株在最大产酶活力时进行凝乳酶的提取并冷冻干燥成凝乳酶冻干粉。通过菌株凝乳酶与商业凝乳酶做凝乳效果对比分析结果显示,该菌株凝乳酶与商业凝乳酶凝乳效果相接近,冻干粉酶活力为1.54×105SU/g与商业凝乳酶活力(3.16×105SU/g)相差不大,后期可对菌株凝乳酶进行分离纯化以获得更高酶活力的纯凝乳酶,并进行酶学特性和相关的凝乳机理研究。此外,分离筛选的纯种解淀粉芽孢杆菌GSBa-1来源于酒曲,与同来源于酒曲中的真菌相比,具有发酵易于控制,产物易于提取分离等优势,更具备产业化开发应用的潜力。
相关新闻推荐
1、尼古丁、烟草浸出液、烟雾提取物对口腔常见微生物的影响(二)
