禽腺病毒(Fowl adenovirus,FAdV)属于腺病毒科禽腺病毒属。目前,基于限制性酶切图谱分析和六邻体序列,FAdV可分为5个基因型(A-E);基于血清交叉中和试验,将5个基因型又细分为12个血清型(1-7、8a、8b、9-11)。由血清4型禽腺病毒(FAdV-4)和血清11型禽腺病毒(FAdV-11)感染导致的肝炎-心包积液综合征(HHS)和包涵体肝炎(IBH)给养禽业带来了巨大的经济损失。
目前针对禽腺病毒的防控,多利用真核表达系统表达特异性抗原蛋白,通过制备亚单位疫苗实现抗禽腺病毒感染的目的。例如FAdV-4的防控,利用杆状病毒表达系统高效表达血清4型禽腺病毒Fiber-2蛋白制备亚单位疫苗,能有效阻断病毒感染传播途径(CN112940084A)。针对FAdV-11的防控,将禽腺病毒fiber蛋白与鸡骨髓源树突状细胞的靶向肽SP序列融合表达制备亚单位疫苗从而实现FAdV-11的精准防控(CN116789850A)。由于禽腺病毒感染常伴随多种血清型出现,因此,需要针对多种血清型的禽腺病毒制备多联疫苗。例如,公开号202310094554.1的专利公开了一种禽腺病毒病四价嵌合病毒样颗粒,以新城疫病毒NA-1株的基质蛋白M为骨架,将I群血清4型禽腺病毒的Fiber-2蛋白、I群血清8a型禽腺病毒的Fiber蛋白、I群血清8b型禽腺病毒的Fiber蛋白、I群血清11型禽腺病毒的Fiber蛋白分别嵌合于新城疫病毒样颗粒载体NDVVLPs表面,得到该禽腺病毒病四价嵌合病毒样颗粒,命名为FAdV4-8a-8b-11cVLPs。还有公开号为CN114214291A的专利构建了一种表达禽腺病毒血清8b型纤突蛋白的禽腺病毒血清4型重组病毒,是利用FAdV-8b的Fiber基因替换FAdV-4Fiber1基因得到,该重组病毒可用于制备防控鸡肝炎-心包积液综合征和/或鸡包涵体肝炎的二联疫苗,利用本发明中的重组病毒制备的二联疫苗可以达到打一针疫苗同时预防两种疫病的效果。然而,目前还未有关于同时免疫防控血清4型禽腺病毒和血清11型禽腺病毒的相关疫苗的报道。
一种表达血清11型禽腺病毒Fiber蛋白的重组血清4型禽腺病毒,基于CRISPR-Cas9技术将血清11型禽腺病毒Fiber蛋白替换重组血清4型禽腺病毒中Fiber-2蛋白,为同时免疫防控血清4型禽腺病毒和血清11型禽腺病毒提供技术支撑和疫苗候选。
一种表达血清11型禽腺病毒Fiber蛋白的重组血清4型禽腺病毒的构建方法
1.病毒基因组的制备:使用天根公司的DNA提取试剂盒进行提取,取血清11型禽腺病毒上清200μL于1.5mL指形管内,按照DNA提取试剂盒说明书进行血清11型禽腺病毒基因组的提取。
2.供体质粒的构建:带有血清4型禽腺病毒基因组左端同源臂HAL和右端同源臂HAR和带有LoxP序列的RFP表达盒的供体质粒HR1-RFP-HR2inpMD 19由本实验室构建并保存,具体的构建方法见专利CN116286685A。然后以HR1-RFP-HR2 in pMD 19质粒载体为模板,利用线性化引物将载体线性化(如图1中B),利用带有质粒部分序列血清11型fiber基因引物以血清11型禽腺病毒380毒株的DNA为模板扩增血清11型禽腺病毒的fiber基因(如图1中B),琼脂糖凝胶电泳后进行胶回收,回收得到的线性化的载体和血清11型禽腺病毒的fiber基因在同源重组酶的作用下将fiber基因连接到HR1-RFP-HR2 in pMD 19质粒上,最终获得携带血清11型禽腺病毒fiber基因和RFP表达盒的供体质粒。最终获得的供体质粒送南京擎科生物科技有限公司测序并由实验室保存。构建供体质粒所用的引物序列见表1。

表1构建供体质粒所用的PCR引物
3.sgRNA表达载体的构建:根据FAdV-4的fiber-2基因序列利用sgRNA在线设计网站(http://crispor.tefor.net/)进行sgRNA的设计。将设计好的sgRNA克隆到lentiCRISPRv2质粒,通过测序进行sgRNA表达载体的验证。具体的sgRNA序列见表2,由南京擎科生物科技有限公司合成。

表2针对Fiber-2基因的sgRNA序列
4.FAdV4-F11重组病毒的拯救:构建策略如图1中A。在6孔板中铺LMH细胞,次日,将3μg sgRNA、3μg的供体质粒以及6μL的转染试剂Mirus加入到200μL的Opti-MEM中,室温孵育45min。随后加入到LMH细胞中,转染6h后换成细胞生长液。转染12h后,弃去细胞生长液,用0.1MOI的FA4-EGFP感染LMH细胞,感染2h后换成细胞维持液。感染FA4-EGFP 3天后,盲传到新的LMH细胞,培养几天后用荧光显微镜观察,若有红色荧光簇出现(如图2中A)证明重组病毒初步构建成功。
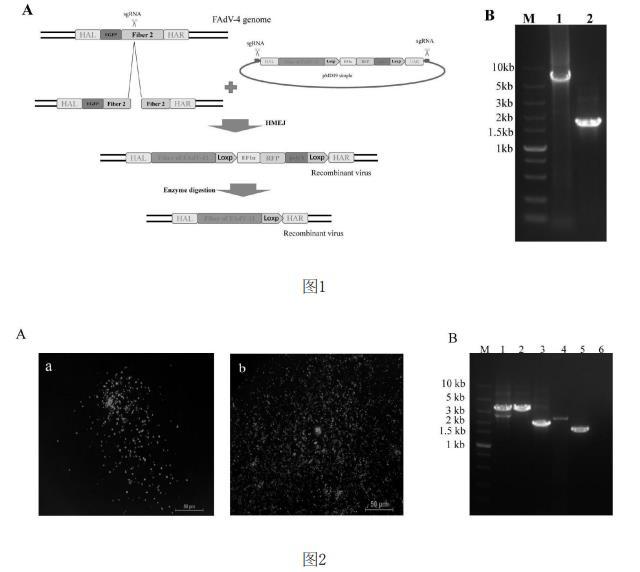
随后在96孔细胞板上利用多轮有限稀释,每次均挑取无绿色荧光有红色荧光的细胞,直至绿色荧光完全消失,获得带有RFP表达盒的表达血清11型禽腺病毒Fiber蛋白的重组血清4型禽腺病毒,并命名为FAdV4-F11-RFP。获得的纯化后的红色荧光重组病毒倍比稀释后接种转染Cre重组酶的96孔LMH细胞板上,2~3d后通过荧光显微镜观察,挑取有细胞病变但无红色荧光的细胞,继续接种转染Cre重组酶的96孔LMH细胞板,重复数次直至红色荧光完全消失获得删除RFP表达盒的重组病毒,命名为FAdV4-F11。通过PCR对获得重组病毒FAdV4-F11进行鉴定(如图2中B),PCR所用的引物见表3。
表3PCR鉴定重组病毒的引物
5.重组病毒中血清11型Fiber蛋白的表达鉴定:用0.1MOI的重组病毒感染LMH细胞,感染2h后换成细胞维持液。感染病毒3天后,用含有蛋白酶磷酸酶抑制剂的细胞裂解液裂解细胞,加入蛋白上样buff煮样后利用血清11型禽腺病毒Fiber鼠多抗和Hexon单抗进行WB验证。
结果如图3中A,FAdV4-F11-RFP与FAdV4-F11均能检测到血清11型禽腺病毒Fiber蛋白和Hexon蛋白。而阴性对照FAdV4-EGFP仅能检测到Hexon蛋白的表达。
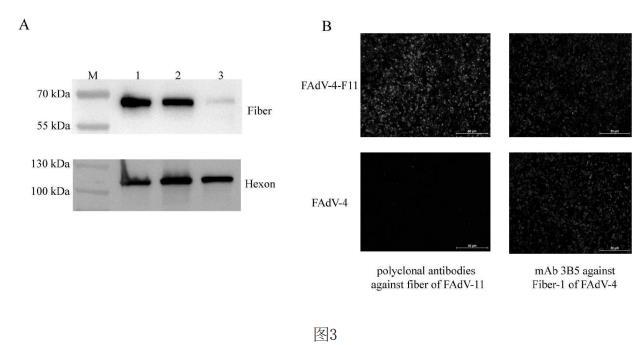
进一步用0.01MOI纯化后不带RFP表达盒的重组病毒接种LMH细胞,3天后将LMH细胞进行固定,利用针对血清11型Fiber鼠多抗和针对FAdV-4Fiber-1蛋白的单抗3B5进行IFA鉴定。
结果如图3中B,重组病毒FAdV4-F11可检测到血清11型禽腺病毒Fiber蛋白和FAdV-4Fiber-1蛋白,表明血清11型禽腺病毒Fiber蛋白成功插入FAdV-4中,并获得良好表达。
6.删除RFP表达盒的重组病毒的生长曲线测定:在6孔板中铺LMH细胞,次日分别用0.1MOI的野生型FAdV-4和重组病毒接种LMH细胞,2h后换成1%维持液,感染后24h、48h、72h、96h和120h收取细胞上清。之后利用TCID50测定病毒各个时间点的病毒滴度,绘制病毒的生长曲线。
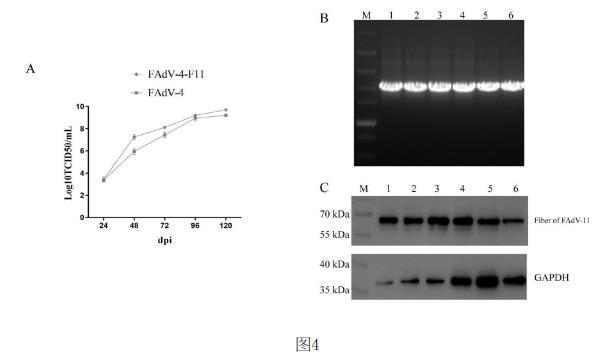
图为重组病毒FAdV4-F11的生长曲线和稳定性结果;A:重组病毒FAdV4-F11的生长曲线;B和C:通过PCR(B)和WB(C)鉴定FAdV4-F11的稳定;M:marker;1~6:第2代、第4代、第6代、第8代、第10代、第12代重组病毒FAdV4-F11。
结果如图4中A,重组病毒FAdV4-F11在LMH细胞上高效复制,在第5天病毒滴度最高达到109.6
TCID50/mL,远远强于野生型FAdV-4的生长速度和滴度。
7.删除RFP表达盒的重组病毒的稳定性测试:将重组病毒FAdV4-F11进行连续传代12代,每隔2代进行提基因组和WB鉴定。
结果如图4中B和C所示,重组病毒FAdV4-F11在LMH细胞中进行稳定复制,并且在第2,4,6,8,10,12代病毒用针对血清11型禽腺病毒Fiber蛋白的鼠多抗进行WB实验均能检测到血清11型禽腺病毒Fiber蛋白,表明连续传代后的重组病毒可以稳定表达血清11型禽腺病毒Fiber蛋白。
8.灭活重组病毒FAdV4-F11在SPF鸡中的免疫原性研究:为了评估灭活重组病毒的免疫原性,将12只14日龄SPF鸡随机分为两组(每组6只)。实验组每只鸡肌肉注射含有106TCID50的灭活油乳剂FAdV4-F110.3mL,对照组鸡肌肉注射含油乳剂的细胞培养基。每天监测两组鸡的临床症状和死亡率,并在14dpi采集血样并用于检测FAdV-4和FAdV-11的中和抗体。
相关新闻推荐
2、应用细胞成像分析装置评价黄芩甙元、壳聚糖和念珠菌和地衣酸对假丝酵母菌和克鲁斯假丝酵母菌中生物膜的影响
