异养浮游细菌对溶解性有机碳(Dissolved Organic Carbon,DOC)的降解消耗是海洋食物网中物质循环和能量流通的主要途径,如在寡营养生态系统中浮游细菌对物质循环和能量流动的贡献是最大的[1]。1983年Azam等[2]科学家提出了微食物环的概念,即相当数量的溶解性有机物(Dissolved Organic Matter,DOM)和颗粒性有机物(Particular Organic Matter,POM)通过原核生物和非常小的真核生物的利用,转化成自身的颗粒有机物,然后被原生动物(主要是鞭毛虫和纤毛虫)捕食后再传递到后生动物,从而进入经典食物链向高营养层传递,在此过程中异养浮游细菌扮演次级生产者的角色;另一方面,海洋浮游细菌(主要是异养浮游细菌)能将生物营养转化中遗失的溶解性有机物和颗粒性有机物分解转化为无机营养盐,促进营养盐循环,并成为海洋群落呼吸释放CO2的主要贡献者,从而起到分解者或还原者的作用。细菌生产力(Bacterial Production,BP)和细菌呼吸率(Bacterial Respiration,BR)分别是反映上述两个生态过程的重要参数,在现场研究中实际以水体异养微生物(包括细菌和古菌)为对象并对其生态功能进行衡量[3-5]。深入了解浮游细菌在海洋生物地球化学循环中的双重角色是目前微生物生态研究的核心内容[6-8]。
细菌生长效率(Bacterial Growth Efficiency,BGE)反映了水生生态系统中溶解有机碳通过异养细菌二次生产转化为自身颗粒有机物的效率,定义为:
BGE=BP/(BR+BR)
BGE是描述水体异养微生物功能和生态角色的重要参数[9],也是评价微生物群落碳收支的关键指标[10-11]。此外,细菌生长效率与其本身的生理条件密切相关,因而可以作为反映水体中细菌生长环境的一个有效指标[12]。细菌生长效率概念的提出,旨在对异养微生物次级生产与呼吸代谢两大生态过程之间的相对关系进行综合研究[13]。近年来细菌生长效率研究越来越受到关注,这得益于人们对细菌呼吸代谢生态学意义的重新审视[14-15]。与单纯的细菌生产力研究相比,细菌生长效率的研究可以弥补异养微生物生长代谢过程中的实际需碳量、对有机碳源的利用效率及损耗比例、系统的营养状态、CO2产出等信息的不足,因而能够更客观地反映异养微生物对微食物环能量流动与物质循环的贡献,并有助于深入开展海洋碳循环体系的生物地球化学研究[12,16-17]。过去测量BP时很少同步测量BR,以致不同海区浮游细菌需碳量(Bacterial Carbon Demand,BCD)到目前为止还是绝大部分未知[14]。在全球气候变化以及海洋碳循环研究深入的大环境下,此方面研究工作的进一步开展有利于深入分析海洋碳的源汇问题,并揭示海洋生态系统在其中所发挥的具体作用[14,17-19]。
细菌生产力
异养细菌生产力的研究方法主要包括[甲基-3H]胸腺嘧啶示踪法[20]、[3H]亮氨酸示踪法[21]、细胞分裂频率法(FDC)[22]、分级或稀释培养中细胞数量的增加法[23]、测定放射性标记的氨基酸或葡萄糖(14C-glucose)[24]等,这些方法的原理及特点的详细阐述见文献[9,25]。此外,还可以根据细菌丰度(Bacterial Abundance,BA)的变化来估算BP[10,26]。目前国内外比较常用的是3H胸腺嘧啶示踪法和3H亮氨酸示踪法,后者也是国标仲裁方法。
细菌呼吸率
目前细菌呼吸率的测定方法主要有两种:
(1)经典的以氧浓度变化为基础的溶解氧滴定法
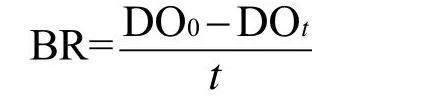
其中DO0,DOt分别为样品培养前后溶解氧浓度,t为培养时间。
呼吸熵(respiratory quotients,RQ)的引入把测定细菌呼吸率的氧单位转变为以碳为单位,定义为:

RQ大小取决于所利用的底物组成,范围为0.7~1.1,通常假定RQ=1[11-12,27-28]。这种方法具有很高的灵敏性和准确性[10,30],也是最常用的方法[11,27-29],后面总结BGE的时空分布规律及其调控机制几乎都是基于这种测量方法计算和分析得出的,但是这种方法局限性带来的潜在影响已经成为BGE研究工作深入开展的瓶颈[31]。
(2)以二氧化碳浓度变化为基础的库仑呼吸测量法
Toolan[32]指出库伦呼吸测量法是基于碳的呼吸率,因而能与初级生产无机碳固定率作对比,并且由于其不需要运用到呼吸熵,所以要比以测氧气浓度变化为基础的方法优越。水体中由于CO2与23CO-相平衡,为了测量通过呼吸产生的CO2,故应测量总溶解无机碳(TCO2):
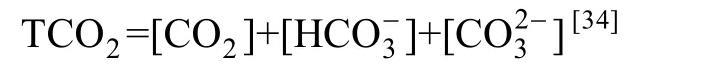
海水中的TCO2利用库仑滴定法来测量。但溶解氧滴定法和库伦呼吸法都需要对实验水样进行至少24 h的培养才能得出测量结果,这就存在以下两方面的问题:一方面,这些测量方法长时间培养过程中的容器效应无法忽视,如为了研究异养细菌,其必须和其他浮游生物相分离,通常经过0.6~2μm滤膜过滤,但完全分离是不可能达到的,所以BR的变化除了细菌外还归因于其他有机体,并且过滤可能会破坏原有细菌聚合的结构,也会改变原有的捕食关系[35]。如果过滤的过程中细胞破碎,则有机和无机物质都会释放出来。此外长期培养可能诱发细菌群落组成的变化或营养物质的消耗[11]。因此结果可能不能代表初始的细菌群落。另一方面,这也难以与基于3H同位素示踪法测量细菌生产力的快速性相匹配(培养时间可在0.5 h以内)并带来相关的误差。在这种背景下,Briand等[10]以及Eichinger等[38]利用高精度连续测量技术将自然水体细菌呼吸率的有效测量时间大大缩减,使培养更接近系统的原始状态,提高了实验的可重复性和精度;Pringault等[39]在2009年也曾报道过利用氧气微电极连续测量技术开展BGE相关研究。
细菌生长效率
早期BGE的值通常基于放射性同位素示踪简单有机化合物的吸收、融合和呼吸测量得到的[40-41],这种方法具有较高的灵敏性,它可以使吸收和呼吸速率经过短期培养后就能测定,即使在生产力不高的水域也能应用。但是在短期培养过程中,细胞内的碳库不能达到平衡,并且细胞内部的同位素稀释和不稳定状态都会使放射性标记化合物产生的生物量偏高,所以这些值现在被认为过高估计自然浮游细菌的实际生长效率[14,33,42-46],此外,细菌可能同时利用多种有机底物,所以只标记单种化合物不能反应细菌利用底物的复杂情况,并可能造成BGE的过高估计。目前主要有两种BGE的测定方法:第一种方法,在相对短的培养时间内(通常小于36 h或小于周转时间)测量BR和BP,这种方法在细菌呼吸率测定方法中已进行了详细阐述。第二种方法是稀释培养,将少量自然条件下的细菌群落接种到过滤无菌水上,观察这些细菌的生长,时间一般为数天或数周。在这种长期试验中,监测DOC和POC的变化很容易,BGE可通过下式估算得出:
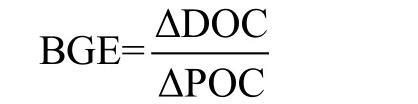
有研究结果表明过滤法和稀释法得到的BGE数据具有一定的一致性[11]。无论采用哪种方法,细菌和天然DOC的来源都将分离,并且细菌和微生物捕食者相分离与营养物质的再生渠道不耦合,这可能对于维持自然系统中高BGE有重要作用。在长期稀释试验中,难降解DOC的消耗量将增加,营养物质的的消耗将增大,在短期过滤法实验中只用大部分可降解性DOC被利用,避免有机物的过度消耗。在长期培养中,异养鞭毛虫的生长不可避免,因此摄食将对细菌生物量和BGE产生重大影响[44,50],并且在长期培养中,有毒代谢产物的积累将使BGE降低。无论是培养时间多长,BR、BP都是变化的,所以培养时间的长短和这些方法的融合对于BGE的计算都很重要。近期报道的缩短培养时间的技术改进(如前面提到的高精度溶解氧测量方法减少呼吸率部分测量时间)对整个BGE估算的质量都有明显改善,但目前BGE的精确测量对于微生物生态学家仍旧是一大挑战。
综上所述,异养细菌生长效率具有明显的波动性,调控机制也较为复杂,不论海洋BGE的关键调控因子是否具有普遍性或存在区域特性,细菌生长效率的研究还需要大量的现场及实验工作。
