《中国兽药典》二〇一〇年版三部规定支原体培养基制成后需进行质控检验,合格后方可用于生物制品的支原体检验[1]。用于质控检验的质控菌株分别为滑液支原体(CVCC2960)和猪鼻支原体(CVCC361)。滑液支原体用于改良Frey氏液体培养基、改良Frey氏固体培养基的质控检验;猪鼻支原体用于支原体液体培养基、支原体固体培养基、无血清支原体培养基的质控检验。为了解两种质控菌株的生长繁殖特性,本试验通过测定两种菌株在不同培养时段的CCU(color change unit,CCU),绘制生长曲线并确定世代时间,为支原体检验用培养基的质控检验提供数据参考。
1材料与方法
1.1材料
1.1.1菌株滑液支原体(CVCC2960)、猪鼻支原体(CVCC361),均由中国兽医药品监察所提供。
1.1.2培养基
1.1.2.1改良Frey氏液体培养基配方为:氯化钠(5.0 g/L),氯化钾(0.4 g/L),硫酸镁(含7个结晶水)(0.2 g/L),磷酸氢二钠(含12个结晶水)(1.6 g/L),磷酸二氢钾(0.2 g/L),葡萄糖(10.0 g/L),乳蛋白水解物(5.0 g/L),酵母粉(5.0 g/L),1%辅酶I溶液(10.0 mL/L),1%L-半胱氨酸溶液(10.0 mL/L),2%精氨酸溶液(20.0 mL/L),马血清(100.0 mL/L),1%酚红溶液(1.0 mL/L),青霉素(800 IU/mL),1%醋酸铊溶液(10.0 mL/L),用1 mol/L NaOH调pH值至7.6~7.8,滤过除菌,置4℃保存备用。
1.1.2.2支原体液体培养基配方为:PPLO肉汤粉(21.0 g/L),葡萄糖(5.0 g/L),10%精氨酸溶液(10.0 mL/L),10倍MEM培养液(10.0 mL/L),酵母粉(5.0 g/L),青霉素(800 IU/mL),1%醋酸铊溶液(10.0 mL/L),马血清(100.0 mL/L),1%酚红溶液(1.0 mL/L),用1 mol/L NaOH调pH值至7.6~7.8,滤过除菌,置4℃保存备用。
1.1.3仪器生物安全柜;37℃恒温培养箱;电子天平;pH计;滤器;冰柜。
1.2方法
1.2.1菌液培养
1.2.1.1滑液支原体将-20℃冻存的滑液支原体菌株恢复原体积后,按5%比例接种到10 mL改良Frey氏液体培养基中培养,取培养后的菌液,按照5%比例传3代,取生长稳定的菌液作为待测菌液,按5%比例接种培养基,置37℃培养箱中培养,从0 h开始,每隔6 h进行一次活菌计数。
1.2.1.2猪鼻支原体将-20℃冻存的猪鼻支原体菌株恢复原体积后,按5%比例接种到10 mL支原体液体培养基中培养,取培养后的菌液,按照3%比例传3代,取生长稳定的菌液作为待测菌液,按3%比例接种培养基,置37℃培养箱中培养,从0 h开始,每隔6 h进行一次活菌计数。
1.2.2生长曲线绘制从0 h开始,每隔6 h从待测菌液中取样,采用10倍系列稀释计数法进行计数。具体方法是:将培养基分装成每管1.8 mL,第1管加入待测菌液0.2 mL,混匀后,取0.2 mL加入第2管中,再混匀,取0.2 mL加入到第3管中,依此操作一直至第10管,将第10管中混匀后取0.2 mL弃去。每个时间点取样3份,将试管置于37℃培养箱中培养,试验设未接种菌液的培养基作为阴性对照。每天观察试管培养基颜色变化,直至培养基颜色不再变化时,结束观察。判定滴度:以培养基颜色变化的最高稀释度作为待测菌液的生长滴度,即CCU表示[2]。用3份样品的平均CCU,n=3)表示该时间点支原体CCU。以取样时间点为横坐标,平均CCU的对数为纵坐标,绘制生长曲线。
1.2.3世代时间的计算世代时间(generation time)[3],即菌体每繁殖一代所需的时间,用G表示。分别取滑液支原体、猪鼻支原体生长曲线对数生长期中的一段,按如下公式计算世代时间:
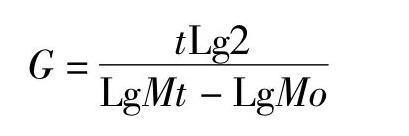
式中,G为世代时间,t为培养时间,Mo为开始时的活菌数,Mt为经t时间培养后的活菌数。
2结果
2.1质控菌株在培养基中不同生长时段的CCU结果如表1、表2所示。从表1可以看出,滑液支原体在改良Frey氏液体培养基中最高可生长至7.0×108CCU/mL,54 h后活菌数开始下降,直至96 h滴度为0。从表2看出,猪鼻支原体在支原体液体培养基中最高可生长至1.0×109CCU/mL,且在126 h之后活菌数开始下降,直至216 h滴度为0。
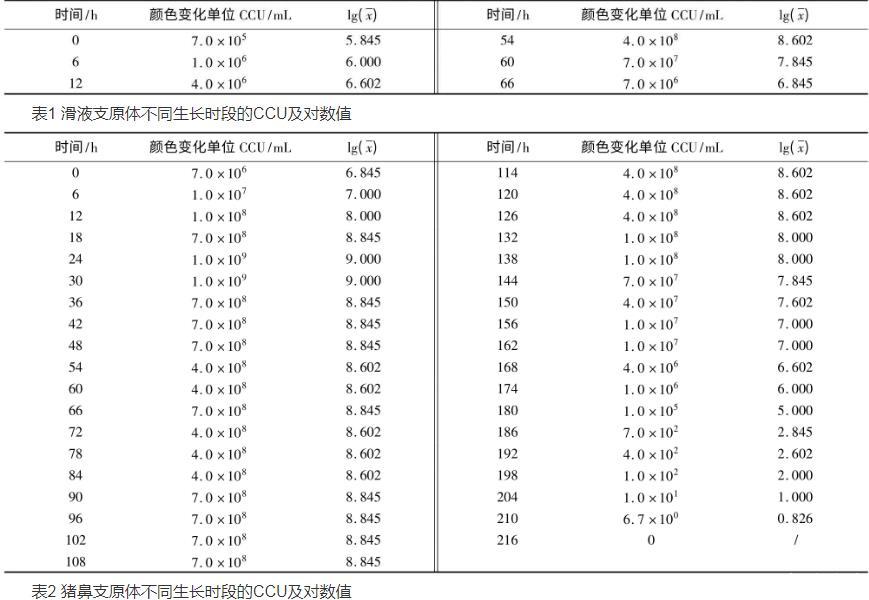
表1滑液支原体不同生长时段的CCU及对数值
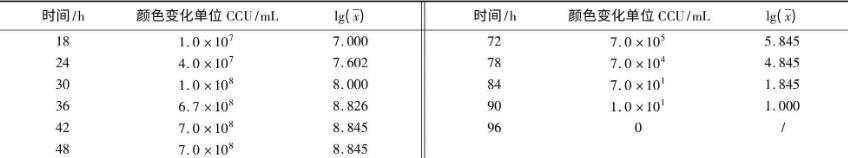
表2猪鼻支原体不同生长时段的CCU及对数值
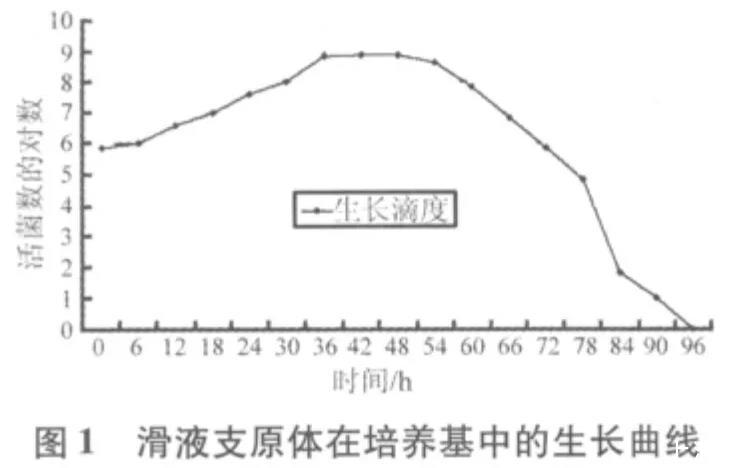
2.2质控菌株的生长曲线图从图1可知,滑液支原体菌株在接种后6 h内为迟缓期,6~36 h为对数期,36~54 h为稳定期,54 h之后为衰老期。从图2可知,猪鼻支原体菌株在接种后6 h内是迟缓期,6~18 h为对数期,18~126 h为稳定期,126 h之后为衰老期。
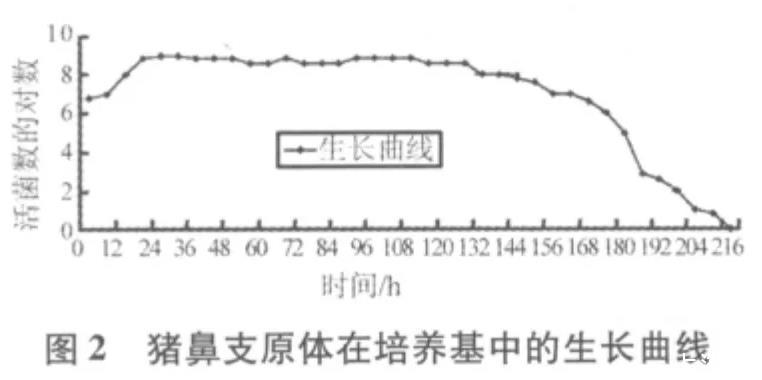
2.3质控菌株的世代时间滑液支原体对数期在6~36 h,t1=12 h,t2=30 h,代入公式,滑液支原体世代时间G=231.8 min;猪鼻支原体对数期在6~18 h,t1=6 h,t2=18 h,代入公式,猪鼻支原体世代时间G=117.1 min。
3讨论
3.1《中国兽药典》[1]规定滑液支原体和猪鼻支原体作为支原体培养基检验用质控菌株,传代培养均不得超过5代。支原体质控菌株开启后,在适宜液体培养基上培养,为使支原体在培养基中生长稳定,连续培养直至第3代,用第3代菌液培养物作为培养基质控菌株的种子液,在用于质控检验时,将种子液继续传代,用第4代或第5代菌液培养物作为质控菌株对培养基进行检验。为了保证质控菌株在培养过程中生长速度稳定、均一,菌液繁殖到第5代终止,不再继续传代。
3.2支原体是一类缺乏细胞壁的原核微生物,它在液体培养基的生长曲线与细菌相同,可分为迟缓期、对数生长期、稳定期、衰老期[4]。为保证质控菌株生长稳定,菌株培养后每次传代,均按照猪鼻支原体3%、滑液支原体5%的比例接种培养基,且每次传代培养均在108CCU/mL数量级收获菌液。从两个质控菌株生长曲线图分析,滑液支原体菌株最佳收获时间在培养后36~54 h,猪鼻支原体菌株最佳收获时间在培养后18~126 h,在此时段内收获的菌液,其CCU均维持在108~109CCU/mL数量级。但在研究中发现,培养时间相差6~12 h的支原体菌液颜色几乎没有差别,而CCU却相差1~2个数量级,这就提示在培养菌液过程中,把握好收获时间至关重要。如果质控菌株不在稳定期中收获,可能导致菌液滴度不够高,即使使用的是合格的培养基,滴度也达不到合格的标准。所以,本研究提示在稳定期及时收获菌液、及时保存,才能保证支原体检验培养基质控菌株滴度的稳定和均一,保证支原体培养基检验结果的准确。
3.3培养基质量直接影响生物制品检验结果的准确性,所以质控菌株作为一个衡量培养基合格与否的标尺,更是起到了至关重要的作用。目前,现行《中国兽药典》在质控菌株标准化方面还没有十分具体的规定。虽然试验初次通过绘制生长曲线和确定世代时间来探索质控菌株的生长规律,为培养基检验及质控菌株的使用提供了一定的数据参考,但是质控菌株的标准化工作还需大量试验进行验证,例如质控菌株的传代次数、菌液接种培养基的适宜比例、生长滴度变化等方面还需进一步确证并作详细规定。另外,在质控菌株培养方面,传统上一直采用肉眼观察的方式对培养液颜色进行判断,试验中发现此方法准确性不高,且不同试验人员判断亦存在差异,建议采用酸度计测定取代肉眼观察方法,使试验结果更可信。
相关新闻推荐
1、Bioscreen C自动生长曲线分析仪:多糖的水凝胶递送系统在益生菌保护作用
2、大肠埃希氏菌BL21-C和BL21-T抗噬菌体能力和生长曲线测定
