2结果与讨论
2.1菌株的分离及活性筛选
本实验以N-乙酰基甲硫氨酸作为分离培养基中的唯一碳氮源。从来自氨基酸类化工厂附近的8份土样中,分离了约500株菌,并对其进行了D-氨基酰化酶活力的初筛与复筛,得到了酶活力及稳定性均较好的菌株A55,酶活力达到70U,并对其进行后续研究。
2.2菌株A55的鉴定结果
2.2.1形态学特征及生理生化特征(表1)
表1菌株A55的生理生化特征
菌株A55在LB固体培养基上生长迅速,菌落圆形呈淡黄色,表面湿润,中心凸起,边缘整齐;在分离固体培养基上生长相对缓慢,菌落点状呈乳白色,表面湿润,边缘整齐。革兰氏染色阳性,杆状,链状排列。
2.2.2 16SrDNA序列分析
PCR扩增得到的菌株A55的16SrDNA序列全长为1 416bp,将该序列与GenBank数据库中细菌及古菌的16SrDNA序列进行Blast分析。结果表明,菌株A55与耐寒短杆菌相似度最高,达到100%,通过Mega5.2软件得到了以16SrDNA序列为基础的系统发育树(图1)。
由图1可知,菌株A55与耐寒短杆菌Brevibacterium frigoritolerans处于同一分支,亲缘关系最近,结合形态学及生理生化特征可以确定菌株A55为耐寒短杆菌。
2.3菌株A55发酵条件的优化
2.3.1培养条件的确定

图1菌株A55的系统发育树
温度及培养基pH值对微生物的生长有着非常重要的影响,摇床转速及摇瓶装样量主要影响微生物的供氧,也是发酵中不可忽视的因素。考察了培养温度、培养基初始pH值、摇床转速、装样量对菌株A55生长及酶活力的影响,结果见图2。

图2培养温度(a)、培养基初始pH值(b)、摇床转速(c)及装样量(d)对菌株A55生长及酶活力的影响
由图2可知:菌株A55的最佳培养温度为30℃,在此温度下,菌体的生长情况及酶活力均较好;菌株A55在初始pH值为5的培养基上无法生长,其最适初始pH值为7;菌株A55发酵的最佳摇瓶转速为200 r·min-1,最佳装样量为15%,这与菌株A55严格好氧密切相关。因此,确定菌株A55适宜的培养条件为:培养温度30℃,培养基初始pH值7,摇瓶转速200r·min-1,摇瓶装样量15%。在此条件下继续考察其它因素的影响。
2.3.2菌龄对菌株生长及酶活力的影响
菌株A55所产的D-氨基酰化酶属于诱导酶,只有在培养基中添加N-乙酰基氨基酸作为诱导物时,菌株才能合成D-氨基酰化酶。菌株A55的生长曲线及菌龄对酶活力的影响见图3。
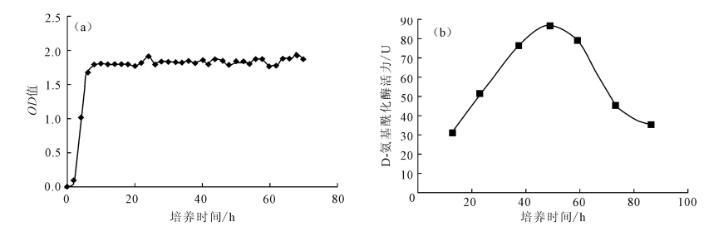
图3菌株A55的生长曲线(a)及菌龄对酶活力的影响(b)
由图3a可知,由于种子培养基与发酵培养基相同,菌株A55调整期非常短暂,很快进入对数期,在第8h即进入稳定期。由图3b可知,菌株A55在36~60h之间D-氨基酰化酶活力较高,第72h活力明显降低,可以判断菌株A55从第60h开始进入衰亡期。因此,确定菌株的最佳培养时间为48h,酶活力达到82.99U。
2.3.3碳、氮源对菌株生长及酶活力的影响
分别添加1%的葡萄糖、蔗糖、淀粉、甘油,0.5%的硝酸钠、硫酸铵、尿素、蛋白胨,以发酵培养基为对照,考察不同碳、氮源对菌株A55的生长及酶活力的影响,结果见图4。
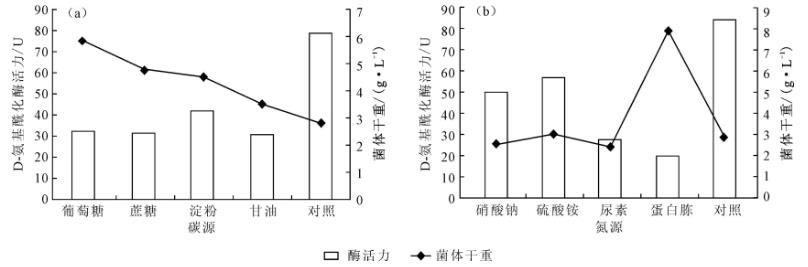
图4碳源(a)和氮源(b)对菌株A55生长及酶活力的影响
由图4a可知,在培养基中分别添加不同碳源后,菌株A55的菌体量均明显增加,葡萄糖的影响尤其突出,菌体量增加至对照的2.08倍;然而D-氨基酰化酶活力均明显降低。由图4b可知,硝酸钠、硫酸铵及尿素等无机氮源对菌株A55的菌体量影响不大,D-氨基酰化酶活力有所降低;相比之下,蛋白胨的添加使菌株A55的菌体量增加至对照的2.78倍,同时蛋白胨对D-氨基酰化酶活力影响也较大,使其降低至对照的24.67%。表明,培养基营养丰富反而抑制D-氨基酰化酶的合成,这与该酶属于诱导酶密切相关。
3结论
从氨基酸类化工厂附近土样中分离出产D-氨基酰化酶的菌株A55,通过形态学观察、生理生化特征测定及16SrDNA系统发育分析,鉴定其为短杆菌属的耐寒短杆菌,具有D-氨基酰化酶活力的耐寒短杆菌此前未见报道。另外,对该菌株的发酵条件进行了初步优化,其最佳产酶发酵条件为:培养温度30℃,培养基初始pH值7,摇床转速200r·min-1,摇瓶装样量15%,培养时间48h。为实现国内D-氨基酰化酶的商品化及酶法合成D-氨基酸的工业化奠定了基础。
相关新闻推荐
2、不同pH、Na2CO3、NaCl浓度对耐盐碱菌株NM-1生长曲线的影响——实验结果与讨论
3、卷丹百合花中分离出的果胶多糖可促进人肠道双歧杆菌生长(二)
