酿酒酵母细胞cdc50基因缺失会抑制细胞生长,改变细胞形态。利用RNA-seq转录组测序技术对野生型酵母菌株BY4742和突变菌株Δcdc50进行比较分析后表明,两组差异表达基因共有581个,其中cdc50基因敲除后上调基因有271个,下调基因有310个。GO功能分析表明,差异表达基因主要富集在生物学过程中的氧化还原过程等,分子功能中的氧化还原酶活性、辅助因子结合和跨膜转运体活性等。KEGG富集分析表明,差异表达基因主要富集在糖酵解/糖异生、脂肪酸降解和碳代谢通路等。本研究为揭示cdc50基因的生物学作用和相关分子机制的提供了理论基础。
细胞形态和生长情况
挑取适量对数期突变菌株Δcdc50和野生型酿酒酵母BY4742细胞,接种到对应的YPD液体培养基中,保证初始样本OD600nm值相同,置于摇床中180 r/min、30℃培养,每隔2 h取适量培养液测其OD600nm值,绘制生长曲线,24 h后取少量菌株BY4742和Δcdc50细胞菌液于载玻片上在显微镜下观察其形态。
细胞生长和形态测定
以培养24 h的野生型BY4742细胞的OD600nm值为对照,分别测量突变菌株Δcdc50在不同时间点的OD600nm值,计算相对生长率,结果见图1A。
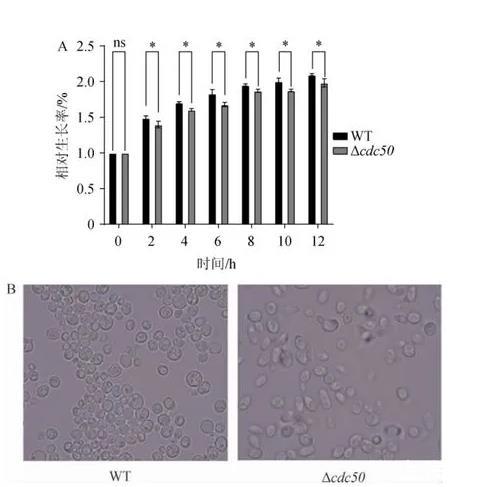
图1野生型酿酒酵母菌株BY4742和突变菌株Δcdc50的相对生长率(A)和细胞形态(B)
由图1A可知,培养2 h、4 h、6 h、8 h、10 h、12 h的突变菌株Δcdc50的相对生长率较野生型酵母BY4742菌株降低,均具有显著差异(P<0.05),其中培养12 h后,野生型BY4742菌株培养的相对生长率为2.10%,突变菌株Δcdc50为1.98%。菌株BY4742和Δcdc50细胞形态见图1B。由图1B可知,显微镜下也显示突变菌株Δcdc50细胞形态与野生型BY4742对比发生了明显的改变。野生型BY4742酿酒酵母细胞为卵圆形,细胞壁完整,边缘清晰;突变菌株Δcdc50细胞多为长杆状,其边缘较为模糊。
结论
酿酒酵母细胞cdc50基因缺失会抑制细胞生长,改变细胞形态。利用RNA-seq转录组测序技术对野生型酵母菌株BY4742和突变菌株Δcdc50进行比较分析后表明,两组差异表达基因共有581个,其中cdc50基因敲除后上调基因有271个,下调基因有310个。GO功能分析表明,差异表达基因主要富集在生物学过程中的氧化还原过程等,分子功能中的氧化还原酶活性、辅助因子结合和跨膜转运体活性等。KEGG富集分析表明,差异表达基因主要富集在糖酵解/糖异生、脂肪酸降解和碳代谢通路等。本研究为揭示cdc50基因的生物学作用和相关分子机制的提供了理论基础。
相关新闻推荐
1、卷丹百合花中分离出的果胶多糖可促进人肠道双歧杆菌生长(二)
