金黄色葡萄球菌(Staphylococcus aureus)是一种引起人和动物感染的重要致病菌,能够引起皮肤、肺等局部感染以及败血症、脓毒症等全身性感染性疾病,严重可致死亡,威胁着人类和动物健康。
尽管目前研究表明PVL在金黄色葡萄球菌致病性中发挥着重要作用,但该毒力因子具体的致病机理还不十分明确,本实验以金黄色葡萄球菌ATCC 49775株为研究对象,利用同源重组的方法构建PVL基因敲除菌株,并对敲除菌株的稳定性和生长特性进行评价,为进一步阐明金黄色葡萄球菌PVL的致病机理奠定基础。
实验内容
敲除菌株和回补菌株体外生长曲线的测定
将敲除菌株ΔPVL、回补菌株CΔPVL与金黄色葡萄球菌ATCC 49775 37℃在TSB液体培养基中,37℃220 r/min培养,每隔30 min取200μL菌液测定一次OD600nm值,试验重复3次,绘制3种菌株的生长曲线。
实验结果
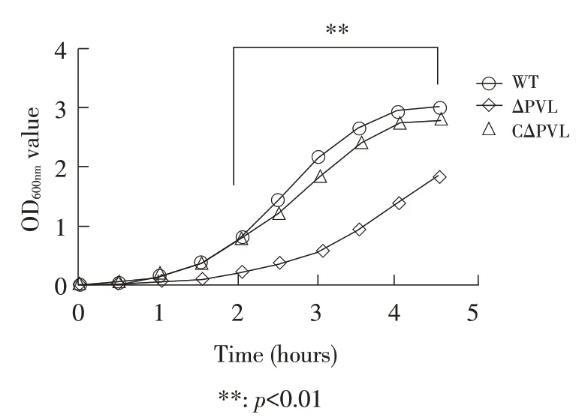
图1敲除菌株ΔPVL、回补菌株CΔPVL与金黄色葡萄球菌ATCC 49775生长速率的比较
在相同条件下分别培养敲除菌株ΔPVL、回补菌株CΔPVL与金黄色葡萄球菌ATCC 49775(WT),根据OD600nm值绘制生长曲线。结果显示,ΔPVL在体外生长较慢并且其生长速率显著低于ATCC 49775野生菌,在培养2 h~4.5 h生长速率差异显著,CΔPVL在体外生长速率与ATCC 49775野生菌基本一致(图1)(p<0.01)。表明,PVL基因的缺失可能影响了金黄色葡萄球菌ATCC 49775的生长速率,推测PVL的合成与金黄色葡萄球菌的生长性能相关。
讨论
PVL由LukS-PV和LukF-PV这两个共转录基因组成,其首次在金黄色葡萄球菌ATCC 49775中被发现,是一种对人类和兔子多核型白细胞具有高度特异性的白细胞素[8]。PVL作为金黄色葡萄球菌的毒力因子,在金黄色葡萄球菌中并不常见,因此对于PVL的潜在威胁知之甚少[4]。目前已有研究报道PVL与原发性皮肤感染和肺炎有关[3],并且对其在皮肤、大脑、呼吸系统和肌肉骨骼等器官或系统的研究结果显示,PVL逐渐成为一种新的全球公共卫生威胁[9-11]。
在对病原微生物的研究中,靶基因的置换或缺失是确定该基因功能、阐明其致病机理的重要手段[12]。目前,利用同源重组的方法对目标基因敲除是研究细菌单基因功能的常用方法,在革兰氏阴性菌中广泛应用。
本研究分别以温敏型质粒pBT2和穿梭质粒pLI50为载体,利用同源重组的方法构建了金黄色葡萄球菌ATCC 49775 PVL的基因敲除菌株和该基因的回补菌株。在构建的敲除质粒中引入ermB基因作为抗性筛选标记,使其具有红霉素抗性,同源重组后一方面将红霉素抗性基因引入ATCC 49775野生菌株中,使重组菌株获得红霉素抗性,进而利用红霉素筛选阳性重组菌;另一方面,ermB基因整合替换了野生菌株中的PVL基因,进而完成了对PVL基因的敲除。
此外,通过对敲除菌株ΔPVL和回补菌株CΔPVL体外生长特性的测定表明ΔPVL与野生型ATCC 49775菌株相比生长速率显著下降,回补菌株CΔPVL与野生型ATCC 49775菌株生长速率基本一致,目前还无PVL基因与金黄色葡萄球菌的生长代谢相关的研究报道。本研究表明,PVL基因可能与金黄色葡萄球菌的生长调节有关,具体机制还需要进一步研究。
本研究构建的金黄色葡萄球菌ATCC 49775的敲除菌株,为进一步研究PVL基因的功能及其在金黄色葡萄球菌感染中的致病机理奠定了基础。
相关新闻推荐
1、苦荞蛋白对肠球菌、肠杆菌、产气荚膜梭菌生长抑制作用及机理(一)
