摘要以东北玉米主产区玉米茎腐病的主要病原菌禾谷镰刀菌(Fusarium graminearum)为研究对象,采用十字交叉法、干重法、生物学检测法以及荧光免疫定量分析等研究方法,研究不同稳定性有机磷源卵磷脂和植酸对禾谷镰刀菌菌丝生长和致病力的影响。结果表明:卵磷脂能显著促进禾谷镰刀菌生长,平板培养试验中,磷浓度为4.38 mmol/L时,卵磷脂组在生长第6天菌落直径可达8.5 cm,而植酸组与K2HPO4组在培养第7天菌落直径还未达到7 cm,生物量测定结果与之相符;不同有机磷不仅影响禾谷镰刀菌的生长,还影响其代谢,磷浓度为43.8 mmol/L时,卵磷脂、植酸发酵培养液对玉米种子的萌发抑制率分别为56.7%和43.3%,分别为K2HPO4的3.4倍和2.6倍,发酵培养液中抑制玉米种子生长的物质是脱氧雪腐镰刀菌烯醇(DON),其中卵磷脂组DON质量浓度最高,为978.55µg/L,植酸次之,为580.79µg/L,二者显著高于K2HPO4(104.51µg/L),且DON质量浓度随着磷浓度的增加而升高;利用有机磷产生DON毒素是禾谷镰刀菌侵染玉米导致玉米茎腐病发生的主要致病机制,根据DON测定结果设置致病力试验,结果表明,以卵磷脂、植酸为磷源时,玉米苗期的发病率分别为98.33%和90.00%,病情指数分别为94和89,与K2HPO4(发病率76.66%,病情指数72)相比禾谷镰刀菌致病力显著提升。此外,还讨论了土壤有机磷生物有效性及其影响因素对玉米茎腐病发生的影响。
禾谷镰刀菌(Fusarium graminearum)是东北玉米主产区玉米茎腐病的主要致病菌。玉米茎腐病又称茎基腐病或青枯病,是典型的土壤传播病害。一般年份的发病率15%~20%,减产约20%,严重时发病率可达70%以上,产量损失约50%,已成为限制我国粮食产量的重要因素之一。不同学者从植物病理学的角度对该病原菌的种类、侵染规律、致病机理以及防治技术等进行了广泛而深入的研究,但近年来,随着玉米重茬面积不断增加,秸秆还田、免耕播种和密植技术的推广应用,玉米茎腐病的发病情况逐年加重。本研究对土壤主要有机磷(植酸和卵磷脂)对禾谷镰刀菌生长及致病力的影响进行研究,以期为耕地地力影响农业有害生物发生的机制与调控提供数据参考,为东北玉米主产区玉米茎腐病的防治提供理论依据。
土壤有机磷是土壤磷库的重要组成部分,包括植酸、核酸、磷脂、磷蛋白、糖脂和其他磷酸盐等。植酸类有机磷占土壤有机磷的40%~80%,对土壤肥力和植物营养的作用受到广泛关注。按Bowman-Cole分级体系,土壤有机磷组分中,中活性有机磷(植酸及其盐类)是构成有机磷的主要组分,活性有机磷(核酸)所占有机磷的比例最小。与无机磷相比,有机磷具有在土壤中移动性强的优点,土壤中磷素的移动绝大部分是有机磷形态,只有小部分可直接被植物根系吸收,其他必须经过进一步矿化为无机磷才能被植物吸收。由于土壤有机磷的矿化不仅通过磷素有效性而且还通过影响根际微生物的性质影响植物的生长,因此,研究土壤有机磷对有害生物种群数量及其致病力的影响,对揭示不同地力因素与土传病害发生的关系,为土传病害防治措施提供理论依据具有重要意义。
1材料与方法
1.1试验材料
1.1.1供试菌种
禾谷镰刀菌(Fusarium graminearum),由吉林农业大学农学院高洁教授提供,分离于玉米茎腐病的病变组织。
1.1.2供试培养基
无磷基础培养基:硝酸钠2.0 g,蔗糖30.0 g,氯化钾0.5 g,硫酸镁0.5 g,硫酸亚铁0.01 g,纯净水1 000 mL,pH 7.0,配制固体培养基加18 g琼脂;马铃薯葡萄糖琼脂培养基(PDA);羧甲基纤维素钠培养基(CMC)。
1.1.3供试磷源
K2HPO4,植酸,卵磷脂。
1.1.4供试玉米品种
吉农大58。使用无菌水和无磷培养基测试种子发芽率分别为98.00%和98.33%,两组测试结果无显著差别。
1.1.5盆栽试验试供试土壤
供试土壤为黑土,土壤基本理化性状:含水量14.91%,有机碳15.26 g/kg,碱解氮89.12 mg/kg,有效磷16.43 mg/kg,速效钾82.89 mg/kg,pH 6.73。
1.2不同有机磷源对禾谷镰刀菌生长及代谢产物的影响
试验设置3种磷源(卵磷脂、植酸和K2HPO4),4个磷浓度梯度(0.043 8,0.438,4.38,43.8 mmol/L),总计12个处理,每个处理3次重复。
1.2.1不同磷源对禾谷镰刀菌生长的影响
(1)十字交叉法:用灭菌打孔器在PDA培养基上打取经活化培养的直径为5 mm的禾谷镰刀菌菌碟,分别接种在以卵磷脂、植酸、K2HPO4为唯一磷源的固体培养基上,对照为K2HPO4,置于25℃培养箱中倒置培养。每隔24 h进行菌落直径的测定,以其中一个处理长满平皿结束测量。菌落实际直径(cm)=测量直径(cm)-0.5。
(2)干重法:将100 mL以卵磷脂、植酸、K2HPO4为唯一磷源的液体培养基分装于250 mL锥形瓶内,K2HPO4作为对照组,总计12个处理,每个处理3次重复。用打孔器在PDA培养基上打取直径5 mm菌碟放入CMC液体培养基中,在25℃光照条件下振荡培养(170 r/min)5 d。显微镜下观察产生大量分生孢子后,发酵培养液经3层无菌纱布过滤掉菌丝,滤液经1.0万r/min离心10 min后收集孢子,加适量灭菌去离子水制成孢子悬浮。每个处理分别接种1 mL禾谷镰刀菌的孢子悬液(2.0×106 CFU/mL,CFU为菌落数),25℃振荡(170 r/min)培养5 d,离心(1×105 r/min)收获菌丝,用无菌水反复清洗5次,105℃烘干至恒重后测定菌丝干质量。生物量(菌丝质量)=总质量-定量滤纸质量。
1.2.2不同磷源对禾谷镰刀菌代谢产物的影响
(1)生测法:将上述培养液高速离心(1×105 r/min),取上清液(约100 mL),于121℃条件下灭菌20 min,冷却后,取15 mL倒入铺有双层灭菌滤纸的培养皿中,将经过质量分数为5%的次氯酸钠溶液表面消毒后的玉米种子20粒整齐摆放其中,以无磷基础培养基离心上清液为对照,总计13个处理,每个处理3次重复。置于28℃恒温光照培养箱中培养6 d后取出,分别测定种子萌发率,胚根和胚芽的长。萌发抑制率和胚根(胚芽)生长抑制率计算公式:萌发抑制率(%)=[(对照萌发率-毒素处理萌发率)/对照萌发率]×100;胚根(胚芽)生长抑制率(%)=[(对照平均长-处理平均长)/对照平均长]×100。
(2)代谢产物的鉴定:取上述经高温高压灭菌后的发酵培养滤液1.0 mL于10 mL离心管中,加入5 mL提取液(体积分数为80%的甲醇水溶液),使用漩涡混匀器振荡5 min后,4 000 r/min离心1 min,取上清液。取100µL离心上清液加入1 000µL样品稀释液中,用漩涡混匀器混匀3~5 s,取100µL分别加入到DON毒素荧光定量检测试纸条加样孔中。置于37℃恒温孵育器中温育8 min后,将试纸条插入荧光免疫定量分析仪(FD-600型,上海飞测生物科技有限公司)中读数,读数值即为样品实际检测浓度。每个样品测3次,取平均值。
1.3不同有机磷源对禾谷镰刀菌致病力的影响
采用盆栽幼苗伤口接种法。制备3种磷源(磷浓度为43.8 mmol/L)培养的禾谷镰刀菌制成的菌碟。以无菌基础培养基为对照,总计4个处理,每个处理设置3次重复。
将采集的健康无病的玉米田黑土过3 mm(6目)筛,去除砾石和植物残体后,按m(N)∶m(P)∶m(K)=29∶13∶10,0.06 kg/m2施肥水平将土壤与肥料混匀后,调节土壤含水量为田间最大持水量的70%,装盆,每盆2.5 kg。每个处理20盆,总计240盆。挑选子粒饱满的玉米种子,经质量分数为5%的次氯酸钠溶液表面消毒。待种子发芽后,种在育苗盆中,每盆种2株,于25℃光照培养室中培育,待玉米幼苗生长定植后,留健壮玉米苗1株,长至15 cm高时进行致病菌接种。在茎基部用牙签轻挑3个伤口,贴上菌碟后用保鲜膜缠绕包裹好,放回培养室中继续保湿培养,5 d后观察发病情况。
玉米苗期病害的病情级别分为4级:0级,健康,整株植株生长正常,未见任何发病;1级,轻度发病,玉米苗接种部位有轻微色变,没有病斑产生;3级,中度发病,玉米植株茎基部发生显著色变,出现少量病斑;5级,重度发病,接种部位变成褐色,病斑明显。有些接种部位茎基完全溃烂,甚至造成植株死亡。发病率和病情指数计算公式:
发病率(%)=(病株数/调查总株数)×100;
病情指数=[∑(各级病株数×相应病级值)/(调查总株数×最高病级值)]×100。
1.4数据处理与统计分析方法
采用Excel 2016和SPSS25.0进行数据统计和差异性分析。
2结果与分析
2.1卵磷脂、植酸对禾谷镰刀菌生长的影响
在十字交叉法培养试验中,根据每天菌落直径的变化,绘制禾谷镰刀菌生长曲线,见图1,卵磷脂、植酸和K2HPO4菌落直径随时间变化均呈上升趋势,说明禾谷镰刀菌能利用3种磷源用于自身生长。在保证培养基中3种磷源磷的物质的量浓度相等的条件下进行比较,以卵磷脂为唯一磷源培养的禾谷镰刀菌菌落生长速度明显快于对照组K2HPO4。当培养基中磷浓度为4.38 mmol/L时,卵磷脂组在生长6 d菌落直径已经达到8.5 cm,而K2HPO4培养基在7 d时菌落直径还未达到7.0 cm(图1)。基础培养基中添加不同磷源对禾谷镰刀菌生长速度的影响见图2。可见,植酸与K2HPO4之间无明显差异,卵磷脂较K2HPO4相比更利于禾谷镰刀菌菌落生长。
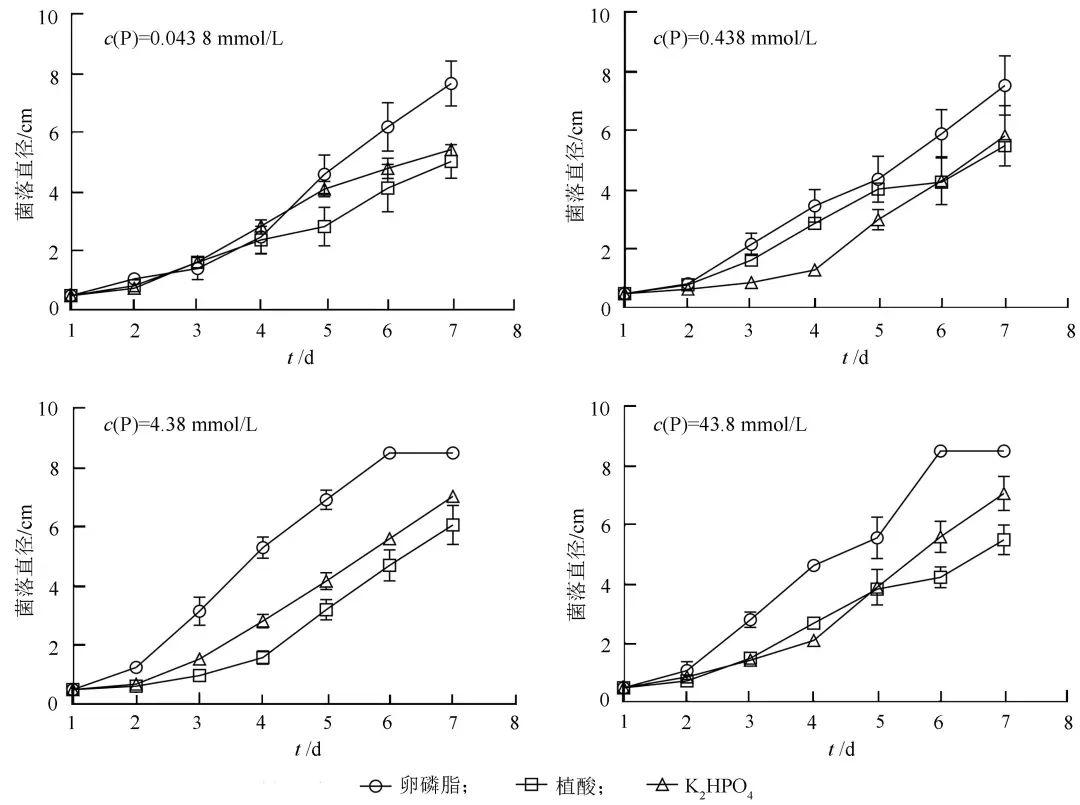
图1基础培养基中添加不同磷源对禾谷镰刀菌生长的影响

图2磷浓度为4.38 mmol/L培养基中禾谷镰刀菌实际生长情况
土壤有机磷源卵磷脂和植酸对禾谷镰刀菌菌丝生长和致病力的影响(一)
土壤有机磷源卵磷脂和植酸对禾谷镰刀菌菌丝生长和致病力的影响(二)
相关新闻推荐
1、引起甜樱桃流胶的病原菌SXYTLJ01生物学特性研究(一)
3、不同耐药性致病副溶血性弧菌在20℃、25℃、37℃下的生长曲线(一)
