1前言
恶性肿瘤是严重威胁人类健康的严重公共卫生问题之一。它具有多样性、复杂性和高致死率的特点,从全球癌症发病率和致死率来看,呈逐年上升趋势。据世界卫生组织(WHO)统计,70%的癌症死亡发生在低收入和中等收入国家,据估计,2030年全球癌症患者将继续上升到1100万。结肠癌(Colorectal cancer,CRC)是世界上最常见的恶性肿瘤之一。近10年来,从全球发病率和死亡率来看,结直肠癌的增长速度基本稳定,但恶性肿瘤的比例有所上升。结直肠癌在世界范围内具有明显的地理分布差异,发达地区的结直肠癌发病率高于欠发达地区。目前,天然产物已被公认为具有预防肿瘤的作用,并有潜力成为化学预防和抗癌候选药物。蚕蛹是一种极具开发潜力和市场价值的生物资源。它资源丰富,具有极高的营养价值和保健作用,具有增强免疫力、降低血糖、延缓衰老等作用。可通过降低氧化作用显著促进脂肪代谢和神经保护功能。Lee等人研究表明,它可以阻止前脂肪细胞的形成,未来可用于治疗饮食性肥胖。日本、韩国等国家已将蚕蛹列为营养食品,在食品领域具有广阔的市场发展前景。
2方法
(1)细胞培养条件
细胞(由中国科学院类型培养库细胞库提供)在含10%胎牛血清和1%抗体(100 U/mL青霉素,100 mg/mL链霉素)的rmii-1640培养基中,在37℃的5%CO2饱和湿化培养箱中培养,用0.25%胰蛋白酶消化使细胞汇合至80%-90%,取对数生长期的细胞用于后续实验。
(2)CCK-8测定细胞密度
5000细胞/100μL于96孔细胞培养板培养5%二氧化碳培养箱在37°C 24 h。100μL(SPP(0,0.8,1.6,2.4,3.2,4.0毫克/毫升)被添加到每个好,复制和6井为每个组在37°C和5%二氧化碳孵化器孵化后24 h。24小时孵化饱和湿度下,100μL介质含有10%CCK-8被添加到每个好,和额外的细胞进一步孵化1 h,并在450nm处记录吸光度。
(3)细胞凋亡检测
取2毫升(1×105个细胞/mL)对数生长期细胞,接种于6孔板中,在饱和湿度的培养箱中,37℃、5%CO2孵育24 h,待细胞生长至融合状态后,弃用培养基,分别用0、0.8、1.6、2.4和3.2 mg/mL的SPP处理各组。细胞培养箱在37℃、5%CO2条件下加湿培养24 h,采用流式细胞仪(Becton,Dickinson and Company,USA)检测ddd-1细胞凋亡率。
(4)实验条件优化
①优化细胞数量
胰酶消化后收集对数生长期DLD-1细胞,离心重悬。分别在Seahorse XFe24细胞外通量分析仪(Agilent Biosciences,Santa Clara,CA,USA)、细胞培养板上每孔添加250μL细胞悬液,使细胞数量分别达到1×104、2×104、4×104、8×104(5个重复)。
②羰基氰对三氟甲氧基苯腙(FCCP)
在确定细胞数量后,通过配置不同浓度的FCCP来运行检测。
③线粒体应激和糖酵解应激试验
通过添加寡霉素、FCCP和鱼藤酮/抗霉素A测定耗氧率(OCR)。
测定不同时间点的OCR值,反映细胞氧化磷酸化水平。细胞产酸速率反映了细胞的糖酵解速率,通过添加葡萄糖、寡霉素和2-脱氧d-葡萄糖(2-DG)来测定细胞糖酵解速率的变化,并测定不同时间点的产酸速率。
3结果与讨论
(1)SPP可抑制DLD-1细胞的侵袭行为
不同浓度SPP处理24 h后,DLD-1细胞生长受到不同程度的抑制,细胞活力随着SSP浓度的增加而逐渐降低,呈剂量依赖性(图1)。与对照组相比,各剂量组细胞活力差异均极显著(P<0.01)。在后续实验中,如果SPP浓度过高,则细胞存活率过低。在流式细胞仪和能量代谢检测细胞时,由于细胞碎片的影响,在后续实验中去除4 mg/mL剂量组。
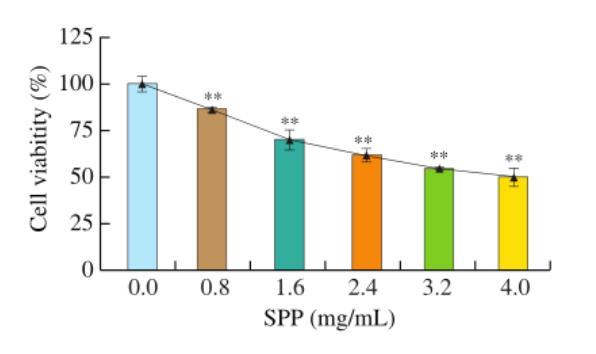
图1 CCK-8分析评估细胞增殖
**与对照组相比P<0.01
(2)SPP诱导DLD-1细胞凋亡
为了进一步确定SPP对DLD-1细胞的诱导凋亡作用,利用Annexin V-FITC/PI对DLD-1细胞进行染色,发现凋亡细胞数量随着SPP浓度的增加而显著增加(图2A)。早期和晚期细胞凋亡比例呈剂量依赖性增加,分别从0.08%增加到7.37%和2.83%增加到23.45%(图2B)。提示SPP可能通过破坏质膜完整性诱导DLD-1细胞凋亡。
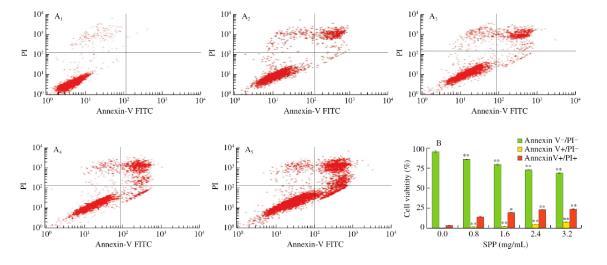
图2 LD-1细胞凋亡变化
(A)DLD-1细胞用碘化丙啶(PI)染色,流式细胞法检测,(A1−A5)SPP分别为0、0.8、1.6、2.4和3.2 mg/mL;
(B)细胞凋亡的定量分析
**P<0.01,*P<0.05
(3)DLD-1细胞能量代谢的变化
在进行线粒体应激测试时,细胞密度对细胞OCR值的测定有很大影响。在本文中,我们发现OCR值随着加入不同数量的单元格而增加。为了保证测试信号的准确性和灵敏度,根据Seahorse XFe24细胞外通量分析仪的说明,在使用24孔生物能量分析仪测定细胞OCR时,正常生长状态的细胞的OCR应在50-400 pmol/min范围内,并在细胞中添加与24孔生物能量分析仪相同数量的细胞。密度应在1×104-8×104 cells/well之间。因此,适宜将细胞维持在8×104(图3A-B)。
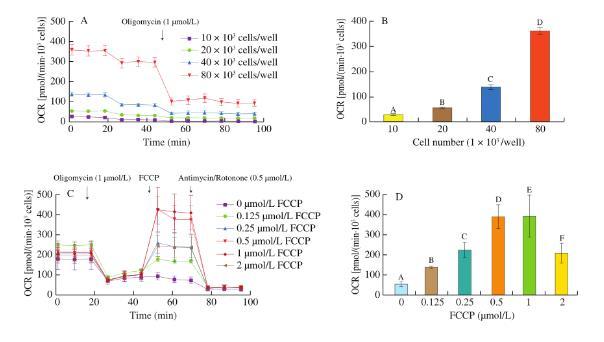
图3 DLD-1细胞数量及FCCP梯度浓度对OCR的影响
(A)不同细胞密度下DLD-1细胞的OCR;(B)不同细胞密度下的基础呼吸速率;(C)FCCP梯度浓度(0、0.125、0.25、0.5、1、2μmol/L)处理DLD-1细胞的OCR;(D)梯度浓度FCCP处理细胞的最大呼吸速率
不同字母表示差异极显著(P<0.01)
FCCP是一种解偶联剂,可降低细胞耗氧量和ATP合酶偶联,增加耗氧量,并作为质子载体。因此,它可以回流大量的质子,导致细胞耗氧量增加。由于电子转移和氧化磷酸化解耦,高浓度的FCCP会对细胞产生毒性,最终导致细胞死亡,因此选择合适的工作浓度很重要。在本研究中,细胞经寡霉素(一种氧化磷酸化抑制剂)处理后,OCR下降,在细胞混合物中加入不同浓度的FCCP来检测OCR的变化。结果表明,随着FCCP浓度的增加,细胞OCR呈增加趋势,在1μmol/L时达到最大值,而当FCCP浓度增加到2μmol/L时,细胞最大耗氧速率水平并没有显著提高(图c3-d),说明FCCP的最佳工作浓度为1μmol/L。
提出SPP可抑制结肠癌DLD-1细胞增殖,促进细胞凋亡。本研究采用Bioenergetics Analyzer测量SPP处理后细胞的OCR,并分析相关参数,以确定SPP对细胞氧化磷酸化过程的影响。随着SPP处理浓度的增加,整体细胞OCR显著降低,尤其是在生长期,FCCP处理后细胞OCR显著降低(图4A)。上述4种氧化磷酸化和电子转移链调节处理使DLD-1细胞的基础呼吸和ATP产量逐渐降低(P<0.01)。与对照组相比,spp处理后的细胞基础呼吸分别下降22.66%、39.38%、61.27%和65.77%(图4B),ATP产量分别下降20.88%、37.73%、45.91%和50.28%(图4C)。
相关新闻推荐
2、HK/RR11双组分系统调控变形链球菌生物膜形成与酸耐受性的机制研究(四)
