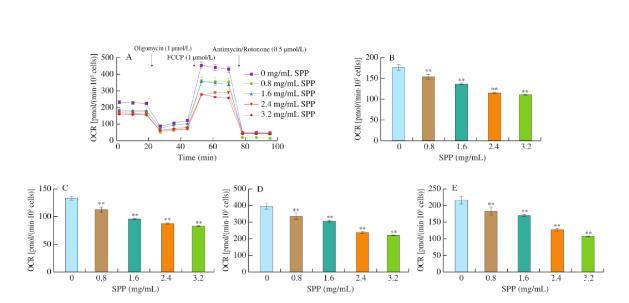
图4 DLD-1细胞线粒体呼吸变化
(A)SPP(0、0.8、1.6、2.4、3.2 mg/mL)处理后细胞OCR的总体曲线;(B)SPP处理后细胞的基础呼吸;(C)SPP处理对细胞A-TP产生的影响;(D)对照组和SPP预处理细胞的最大呼吸量;(E)对照组和SPP预处理细胞的呼吸变化
**与对照组相比P<0.01
随着SPP浓度的增加,DLD-1细胞的呼吸作用和辅助呼吸作用逐渐减弱(P<0.01)。与对照组相比,spp处理后细胞的最大呼吸分别降低了56.81%、87.27%、154.69%和170.70%(图4D),辅助呼吸分别降低了34.15%、47.89%、88.92%和109.40%(图4E)。这说明SPP在很大程度上抑制了细胞线粒体能量代谢过程。
Warburg等发现肿瘤细胞在生长过程中通过切换代谢途径来适应缺氧环境,肿瘤细胞糖酵解速率增加就是证明,即使在回到常氧条件后,肿瘤细胞仍继续依赖糖酵解来产生能量。这个代谢过程被定义为好氧糖酵解。生物能量分析仪能够研究细胞的耗氧速率,可应用于细胞糖酵解的研究。本研究采用Bioenergy Analyzer测定SPP处理后细胞糖酵解的变化,探讨SPP对细胞糖酵解的影响。
随着SPP浓度的增加,细胞糖酵解过程明显受到抑制,细胞外酸化率(ECAR)整体水平明显降低(图5A-B),表现为基础糖酵解逐渐降低速率,细胞糖代谢速率,最大糖酵解速率和剩余糖酵解能力。与对照组相比,SPP处理组的基础糖酵解率分别降低4.58%、5.70%、7.68%、8.01%(图5C),细胞糖代谢率分别降低20.19%、30.37%、39.21%、72.72%(图5D),最大糖酵解分别降低26.16%、38.40%、40.79%、62.46%(图5E),备用糖酵解能力分别降低20.11%、28.17%、63.50%、68.77%(图5F),差异均有统计学意义(P<0.01)。以上结果表明,SPP可显著降低细胞糖酵解水平。
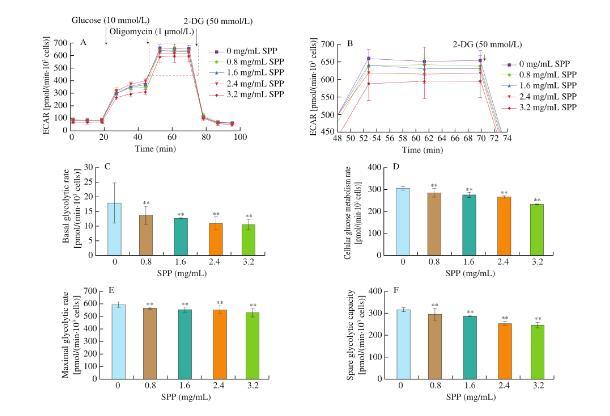
图5 DLD-1细胞有氧糖酵解调节的变化
(A)SPP预处理细胞整体ECAR曲线;(B)A放大46.5-73.0 min;(C)对照和SPP预处理细胞的基础糖酵解率;(D)SPP处理前后DLD-1细胞糖酵解转化能力;(E)对照组和SPP预处理后DLD-1细胞最大糖酵解速率;(F)SPP处理后DLD-1细胞剩余糖酵解能力的改变
**与对照组相比P<0.01
4结论
结直肠癌是全球第三大常见恶性肿瘤,发病率最高(10.2%),其发病率和死亡率在发达国家和经济转型国家之间差异很大。根据美国癌症研究所(AICR)和世卫组织国际癌症研究机构(IARC)发布的最新数据,结直肠癌是男性第三大常见癌症,女性第二大常见癌症,2018年全球新发病例超过180万例,预计到2030年全球结直肠癌负担将增加60%。癌症治疗后,如化疗、手术和放射治疗,普遍存在潜在的或严重的毒副作用。因此,迫切需要开发新型有效、无毒的抗肿瘤药物。近年来,天然药物在癌症治疗中发挥着重要作用。各种具有抗肿瘤活性的蛋白质或多肽已被研究用于与化疗药物的联合抗肿瘤作用。与抗癌药物相比,具有生物活性的蛋白质或多肽是首选,因为它们没有致畸作用,没有累积毒性,不容易导致耐药。在本研究中,一定浓度的SPP可显著抑制DLD-1细胞的生长和增殖,并呈剂量依赖性。
细胞凋亡是一种程序性的细胞死亡,是正常生物清除衰老和不功能细胞,维持正常细胞代谢平衡的防御机制,在细胞的多种功能中发挥重要作用。细胞凋亡的典型形态特征有:凋亡启动后细胞形态呈圆形,随后细胞黏附消失,细胞间连接断开,细胞质浓缩,核染色质浓缩高密度,核裂解,核内出现典型的空泡结构,核膜复杂,凋亡小体晚期分裂为多个凋亡细胞。细胞凋亡除了作为正常生理过程发生外,体外环境因素也可诱导细胞凋亡。细胞凋亡在包括癌症在内的许多疾病的发生发展中起着重要作用,细胞内线粒体的这种调节功能的关闭导致细胞凋亡不足和细胞过度增殖。
当细胞凋亡被阻断,导致平衡被破坏时,这反过来为肿瘤的形成奠定了基础。结果表明,SPP可诱导结肠癌DLD-1细胞凋亡,促进细胞死亡。肿瘤细胞的快速增殖将耦合对能量的更大需求,因此,针对肿瘤的生物能量代谢已成为癌症治疗的一种新的有效预防途径,高效完整地研究分子或药物对肿瘤细胞能量代谢的影响已成为主要问题。生物能量分析仪采用固态探针和获得专利的瞬时微室技术,实时、灵敏、准确、无损地检测细胞能量代谢状态,可以同时测量细胞中两种主要的能量代谢途径——线粒体呼吸和糖酵解。细胞能量代谢的主要指标,如基础呼吸、ATP生成、最大呼吸、基础糖酵解速率、最大糖酵解速率、备用糖酵解能力等,为细胞能量代谢的测定提供了一种新的、方便、快速的方法。
在本研究中,SPP对基础呼吸、最大呼吸、储备呼吸和ATP转换表现出剂量依赖的抑制作用,但剂量效应关系可能是非线性的。这种下降可能是由于SPP处理细胞的凋亡状态和活性氧(ROS)水平的增加可能引起细胞的氧化损伤,进而降低线粒体呼吸链复合物的活性,影响线粒体ATP合成能力,高剂量(3.2 mg/mL)SPP对细胞线粒体有氧/氧化活性的影响。这可能与线粒体能量代谢紊乱直接相关,具体机制有待进一步研究。糖酵解能在缺氧条件下迅速为细胞提供能量。结果表明,SPP可降低DLD-1细胞的糖酵解,影响其糖酵解功能,但损害程度低于基础耗氧率和有氧呼吸最大值的降低,提示SPP对细胞能量代谢的主要影响是由于线粒体功能的损害。
综上所述,本文主要研究了不同剂量SPP对人结肠癌DLD-1细胞能量代谢的影响。其作用机制可能与抑制细胞增殖、促进细胞凋亡有关。海马XFe24细胞能量代谢分析仪可灵敏检测基础有氧呼吸速率、ATP耦合有氧呼吸速率等指标的变化。为SPP诱导肿瘤细胞坏死提供了可行性,但能否应用于临床治疗尚需进一步探索。
相关新闻推荐
1、微生物培养基的分类和用途|常见标本类型及对应的培养基选择
3、基于全自动生长曲线分析仪研究单增李斯特菌低温生长机制(一)
