反刍动物瘤胃微生物对饲料消化能力起决定性作用,介于对宿主的营养素供应影响其泌乳性能和饲料效率。牛月形单胞菌(Selenomonas bovis)作为高饲料转化效率奶牛瘤胃中的基石微生物,可主导更高效的碳水化合物底物利用与代谢功能活性,是高效奶牛瘤胃菌群和功能调控的重要靶点微生物。牛月形单胞菌是月形单胞菌属的一种,是参与瘤胃发酵的重要细菌。其对反刍动物的生糖以及丙酸的生成起重要作用。利用多种宏组学联用技术系统研究,揭示了不同互作机制下的瘤胃微生态对奶牛饲料转化效率的影响;发现在高效动物瘤胃中,牛月形单胞菌的丰度上调4倍,并主导了几个产琥珀酸细菌的正向互作。此外,遗传学特性分析发现牛月形单胞菌为具有中等遗传力(遗传力为0.31)的可遗传瘤胃细菌,因其稳定的代际遗传特性而具有重要调控潜力,提示靶向调控瘤胃微生物牛月形单胞菌的丰度和功能可为精准调控反刍动物饲料转化效率提供新的可能。因此,分离筛选瘤胃丙酸生成菌-牛月形单胞菌对研究反刍动物瘤胃微生物丙酸代谢和调控提供理论基础,对牛月形单胞菌进行体外分离培养具有重要科学和生产意义。
下面提供一种牛月形单胞菌分离培养方法,成功从奶牛瘤胃液中分离出牛月形单胞菌,该牛月形单胞菌可调节碳水化合物的趋化性,是高效奶牛瘤胃菌群和功能调控的重要靶点微生物。
一种牛月形单胞菌分离培养方法,包括以下步骤:
步骤1、基于瘤胃插管技术进行瘤胃液采集:采样当天于晨饲前(04:00-06:00)采用口腔插管法采集奶牛瘤胃内容物,采集的瘤胃内容物用4层滤网(180目)进行过滤得到瘤胃液,然后将瘤胃液装入螺旋离心管中,并迅速向其中通入CO2;
步骤2、培养前的材料制备与准备工作:材料准备包括专性厌氧杆菌营养液、LB固体培养基、LB液体培养基、PYG培养基、维生素K1、血红素、马血清、二柳苏糖醇(DTT)、基本培养基MM、PMD18-T载体、感受态细胞、细菌基因组DNA小量制备试剂盒、PCR产物回收试剂盒、日常型质粒DNA小剂量纯化试剂盒、PCR扩增用材料:包括生化反应管(31种)、Taq DNA聚合酶、dNTPs Mix-ture、5mg/ml EB、rTaq DNA聚合酶(5U/μL)、DNAMarker DL 2000、DNAMarker DL15000、dNTPs(2.5mmol/L)、Biospin胶回收试剂盒;
步骤3、牛月形单胞菌的分离;
将瘤胃液于37℃迅速送回实验室在600r/min下离心10min,以去除瘤胃液中的饲料颗粒及纤毛虫等微生物,取上清液,用生理盐水梯度稀释,然后各取50μL不同梯度的稀释液用L棒均匀涂布于固体培养基中,在厌氧工作站或用厌氧培养袋在39℃条件下培养48h,取单个40μL菌落在新鲜LB固体培养基上划线,纯培养,并进行专性厌氧杆菌营养液的液体培养,在厌氧工作站中在37℃下恒温培养48h,再进行革兰氏染色镜检;
称取PYG培养基基础18.04g,加热溶解于500mL蒸馏水中,121℃高压灭菌15min后,冷却至50℃,加入过滤除菌的维生素K1溶液0.5mL、血红素溶液(5mg/mL)2.5mL,以及25mL灭菌瘤胃液、25mL马血清和0.1gDTT,使用8M NaOH将pH值调整至7.2,混匀备用;菌株保藏,将单个菌落接种于新鲜的液体全营养培养基,在厌氧培养箱(85%氮气、10%二氧化碳和5%氢气)中过夜,然后取菌液加入到灭菌甘油(浓度15%-20%)中,使用厌氧培养箱于37℃条件下培养48h,接着无菌条件下加入2mL细菌悬液至营养肉汤中,将细菌和肉汤混匀使细菌最终浓度为108-109cell/mL;基于冻干法在无菌条件下将细菌分装到有灭菌玻璃珠的冷冻管中,反复吹打,使珠子内部的气泡完全被细菌悬液替代,吸去冷冻管内多余的液体,将混有细菌和珠子的冷冻管放入-80℃冰箱保存。
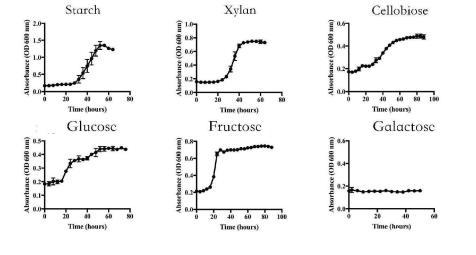
步骤4、利用常规细菌接种法进行生化试验:将活化至对数生长中期的菌株以2%(v/v)的接种量接种于基本培养基MM中,分别以0.5%多糖(淀粉、葡聚糖、木聚糖、甘露聚糖、菊粉、地衣多糖、木葡聚糖)、0.5%二糖(纤维二糖、木二糖、甘露二糖)或0.5%单糖(葡萄糖、果糖、甘露糖、鼠李糖、半乳糖)作为唯一碳源底物,置于厌氧培养箱中于37℃条件下培养;利用Bioscreen全自动微生物生长曲线测定仪连续测定80h,且每4h进行一次OD600值测定,绘制可代谢碳源底物谱和生长曲线,试验重复3次;生长曲线如图1所示,从图中可以看出,以淀粉、木聚糖、纤维二糖、葡萄糖、果糖或半乳糖作为可代谢底物时有利于菌株生长。
毛细管趋化试验具体步骤为:
挑取单菌落培养至OD600为0.1-0.2,将菌株使用趋化缓冲液(50mM磷酸钾缓冲液添加到20μM EDTA、0.05%甘油中,pH7.0)洗涤2次,在1200g下低速离心3min后,用相同缓冲液稀释至OD600为0.05,然后将细菌悬液分装于96孔板;使用趋化缓冲液配制不同浓度的效应物分子-可代谢碳源底物,将毛细管一端热封,填充趋化缓冲液以及加入碳源底物效应物的趋化缓冲液,毛细管开放段浸于细菌悬液中,趋化30min后,将毛细管从细菌悬液取出,用ddH2O冲洗表面,内容物全部吹打并涂布于LB琼脂平板,37℃条件下厌氧培养24h,记录菌落形成单位(CFU),减去空白趋化缓冲液的毛细管细菌数进行校正,得到趋化细菌数目,并计算趋化性指数。

结果如图2所示,以淀粉、木聚糖、纤维二糖、葡萄糖、果糖或半乳糖作为可代谢底物时,趋化性指数均大于1,说明牛月形单胞菌对淀粉、木聚糖、纤维二糖、葡萄糖、果糖或半乳糖可代谢底物产生正向趋化。
软琼脂平板趋化试验具体步骤为:
将培养至对数期的菌液(OD600为0.5-0.7),使用趋化缓冲液洗涤3次,在1200g下低速离心3min后,将10μL浓度为100μM的碳源底物效应物点板于含0.25%(w/v)琼脂的固体MSB中,4℃过夜;在趋化平板中央效应物原点两侧等距离接种菌液1μL,共接种2个点,然后将趋化平板在30℃下培养20-30h后拍照。
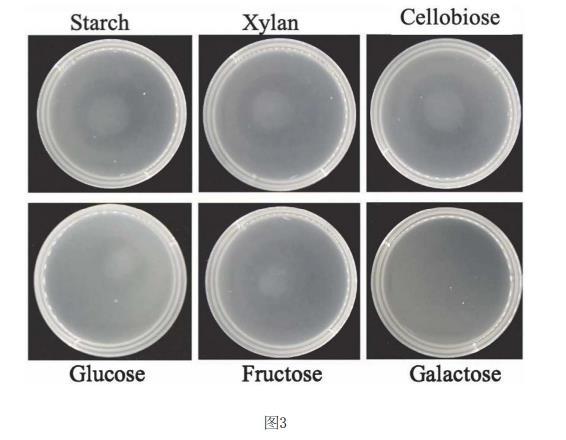
结果如图3所示,以淀粉、木聚糖、纤维二糖、葡萄糖、果糖或半乳糖作为可代谢底物时形成了明显的趋化圈,说明牛月形单胞菌可调节碳水化合物的趋化性。
步骤5、菌株16S rDNA基因序列鉴定:用细菌基因组DNA小量制备试剂盒提取牛月形单胞菌DNA并以其为扩增模板,退火温度为50℃,35个循环,进行PCR扩增,电泳观察结果;用PCR产物回收试剂盒回收特异DNA片段的PCR产物,将其连接在PMD18-T载体上,16℃连接过夜;将连接产物转化入大肠杆菌DN5α株感受态细胞中,摇菌1h后将菌液涂在Amp+的LB琼脂平板上37℃恒温振荡培养12-16h;用日常型质粒DNA小剂量纯化试剂盒提取重组质粒,电泳观察提取结果;PCR扩增重组质粒,电泳观察并送TaKaPa公司对其测定序列,由DNAsis软件分析测序结果;设计细菌16S rRNA基因片段PCR扩增通用引物,上游引物序列为:5′AGAGTTTGATC(A/C)TGG3′,下游引物序列为:5′GGACTAC(A/T/C)AGGGTATCTAAT 3′,引物由上海生工生物工程技术服务有限公司合成;提取分离菌株的基因组DNA扩增其16SrDNA基因片段与GenBank中发表的牛月形单胞菌16S rRNA进行基因序列同源性分析,同源性为97%,确定分离菌株为牛月形单胞菌。
相关新闻推荐
2、新发现BfmAK信号系统控制嗜麦芽寡养单胞菌生物膜形成(三)
