虾酱是具有一定营养价值的传统发酵食品之一,一般以毛虾、虾头或者虾肉为原料。这些原料在内源酶及微生物共同作用下,经过一段时间发酵,其中的蛋白质和脂肪发生水解,转化为多肽、氨基酸和有机酸等具有生物活性的物质,同时也形成虾酱特征风味。虾酱中微生物群落复杂,涉及到乳酸菌、芽孢杆菌等多种菌群参与。菌株在发酵过程中产生的蛋白酶或脂肪酶等代谢物能促进虾组织的水解,进而加速发酵过程;产生的抑菌物质则可在一定程度上防止腐败发生,从而减少虾酱中盐分的添加。发酵温度、时间、调味料的添加以及是否接种发酵剂都会对虾酱微生物群落组成产生影响。
芽孢杆菌是革兰氏阳性杆菌,依靠鞭毛运动,属于好氧或兼性厌氧菌,能产生孢子。芽孢杆菌对外界环境的适应能力较强,能在比较不利的温度和pH范围下存活。芽孢杆菌及其分泌的多种代谢物具有抑菌、抗氧化等功效。部分芽孢杆菌因为具有产胞外蛋白酶、酯酶和甲壳素酶的能力,可以用作发酵剂发酵虾酱。研究表明芽孢杆菌在虾酱发酵的过程中对菌群和风味的变化起到了非常重要的作用。也有研究表明从传统发酵虾酱中筛选出的枝芽孢菌ZV10-1和尼泊尔葡萄球菌JS11组合作为发酵菌株发酵虾酱,采用顶空气相色谱-离子迁移谱/质谱(HS-GC-IMS/MS)方法鉴定出虾酱中含有95种挥发性化合物,其指纹图谱与传统虾酱相似,芳香和支链醛的含量却有所增加,更有助于产生宜人香气。植物乳杆菌和解淀粉芽孢杆菌混合发酵也可以缩短发酵周期,改善虾酱颜色,并可增加其中的谷氨酸含量。但对芽孢杆菌作为发酵剂对虾酱细菌菌群的影响较少,还有待进一步研究。
基于目前的研究状况,本研究以前期从自然虾酱中分离的具抑菌和抗氧化功能、产蛋白酶和脂肪酶并且具有溶血安全性的解淀粉芽孢杆菌B.amyloliquefaciens Y11和贝莱斯芽孢杆菌B.velezensis Y12为发酵剂,参考目前低盐虾酱的盐分含量,以10%(w/w)作为虾酱制作食盐添加量,研究单菌和混菌发酵对虾酱品质和微生物菌群变化的影响,为虾酱发酵的方法开发提供一定的理论依据。
虾酱制作
选定前期从自然虾酱中分离解淀粉芽孢杆菌B.amyloliquefaciens Y11和贝莱斯芽孢杆菌B.velezensis Y12为发酵剂,将毛虾清洗搅碎后接入发酵剂(1%,v/v),区别于传统发酵中20%~30%高盐添加量,参考目前已有制作低盐虾酱所采用的12%(w/w)的盐分含量(其盐分含量在8周发酵时间内在10%~13%区间波动),本研究所采用的盐分添加量为10%(w/w),分别设置A、B、C、M四组。其中A组接入发酵剂解淀粉芽孢杆菌Y11;B组接入发酵剂贝莱斯芽孢杆菌Y12;C组为对照组(不接入菌株作为发酵剂)采取自然发酵方式;M组为同时接入发酵剂解淀粉芽孢杆菌Y11和贝莱斯芽孢杆菌Y12(1:1,v/v)进行混菌发酵,于室温(20℃左/>右)进行。在F1(发酵的起始阶段)、F2(发酵10 d)、F3(发酵80~90 d)、F4(发酵120~130 d)对四组样品分别取样(图1)。

虾酱菌群多样性分析
按照发酵时间点分别对虾酱样品DNA进行取样,使用Ezup柱基因组DNA纯化试剂盒提取总基因组DNA。使用TransStart Fastpfu DNA聚合酶扩增细菌16S rRNA基因的V3~V4区。PCR产物使用sanpercolumn PCR产物纯化试剂盒进行纯化。使用Illumina HiSeq平台对16S rRNA基因进行测序。探究发酵虾酱细菌菌群结构。
虾酱微生物群落变化分析
采用扩增子测序对虾酱的细菌微生物多样性进行分析(图2),在属水平前10种微生物主要有:Alkalibacterium(嗜盐嗜碱菌)、Atopostipes(肉杆菌)、Psychrobacter(嗜冷杆菌)、Jeotgalibaca(咸海鲜芽孢杆菌)、Methylotenera(甲基营养型反硝化菌)、Ralstonia(罗尔斯通菌)、Staphylococcus(葡萄球菌)、Pseudomonas(假单胞菌)、Tetragenococcus(金黄色四联球菌)、Salinicoccus(盐水球菌)等为虾酱发酵过程中的主要优势菌群。
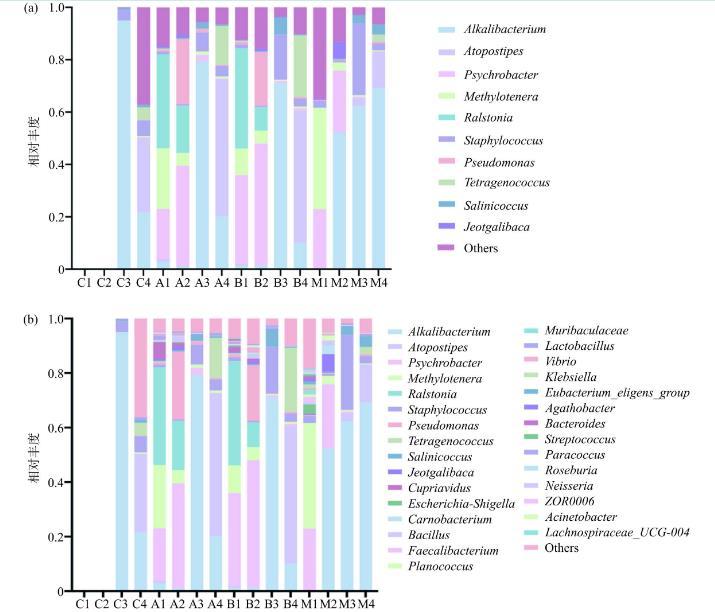
图2属水平相对丰度Top10(a)和Top30(b)
注:横坐标大写字母A、B、M、C分别对应解淀粉芽孢杆菌Y11、贝莱斯芽孢杆菌Y11、两种芽孢杆菌混合发酵和自然发酵,数字1~4分别对应F1~F4四个不同发酵阶段;Others表示图中所列属之外的其他所有属的相对丰度之和。
研究结果表明,对于自然发酵虾酱F1、F2阶段采用本实验方法和相同取样量没有检测到菌群的存在,可能由于其中菌群的丰度较低以及样品DNA降解的原因;在F3发酵阶段Alkalibacterium丰度最高,菌群多样性较低,在F4阶段,菌群多样性增高,说明自然发酵虾酱菌群丰度和多样性的增加需要时间较长。A、B和M组在F1阶段,可检测到多个属的菌群存在,但菌群相比百分比有所不同。单菌发酵A组、B组的Ralstonia、Psychrobacter、Methylotenera三种微生物占比较高,混菌发酵组M组Psychrobacter、Methylotenera两种微生物相对丰度较高,Ralstonia微生物相对于A组、B组较低,但整体的微生物相对丰度分布的趋势较为相近。在F2阶段中,单菌发酵组A组、B组中Psychrobacter微生物相对丰度仍在增加,但Ralstonia在此阶段有明显的减少趋势,Methylotenera也在相对减少,但在混菌发酵组M中,与A组、B组不同的是,Alkalibacterium在第二阶段呈现出迅速增加的状态。在发酵时间到达80~90 d时,A组、B组中Alkalibacterium、Staphylococcus逐渐占据优势地位。在F4阶段,Alkalibacterium、Staphylococcus成为优势菌,混菌发酵组M组和自然发酵组C组与以上的菌群结构相同。
虾酱中细菌群落的构成与地域和发酵工艺有关,同时也在很大程度上决定了虾酱的品质和风味。研究发现泰国虾酱中,在发酵初级阶段,Salimicrobium spp.(53.6%))和Salinicoccus spp.(44.0%)丰度最高,随着发酵时间的延长,菌群的多样性和丰度也发生变化,Alkalibacterium,Macrococcus caseolyticus,Jeotgalicoccus psychophillus和Staphylococcus spp.等则逐渐占据优势。可以分泌氨肽酶的细菌的存在由于可通过水解提高与滋味形成有关的二肽和三肽的含量,因此对虾酱滋味的形成非常重要。Alkalibacterium spp.,Jeotgalicoccus spp.,Lentibacillus spp.,Salimicrobium spp.,Salinicoccus spp.和Staphylococcus spp.等菌株的存在都与水产品风味肽的形成有关,包括γ-Glu-Val-Gly和γ-Glu-Val等。另外Tetragenococcus以及Pseudomonas与非有机硫化物、氮氧化物以及长链烷烃的形成有关,Psychrobacter等与酯类等芳香化合物的形成有关。菌群组成与电子鼻初步分析结果较为一致,同时混菌发酵菌群在F1阶段与自然发酵虾酱菌群组成类似,也进一步证实了混菌发酵可以缩短虾酱制作时间,可以在较短时间内获得类似自然发酵虾酱风味。
结论
本研究以B.amyloliquefaciens Y11、B.velezensis Y12菌作为发酵剂,探究单菌和混菌发酵在四个不同时间段对发酵虾酱样品的理化指标及菌群结构变化的影响。结果表明加入混菌发酵M组、单菌发酵A组、B组发酵虾酱样品与自然对照组C组相比,其理化指标如感官、颜色等,化学指标如MDA值、TVB-N值以及菌群结构变化等都存在一定的差别。其中对混菌发酵的样品来说,在10~80 d品质较好,120 d左右混菌发酵虾酱样品的品质指标变化较大,可能会具有一些潜在食用安全隐患。综上分析,研究表明加入发酵剂可对发酵虾酱的品质及菌群结构发生改变,但要控制接入发酵剂的含量及发酵时间的长短。本研究对芽孢杆菌菌株作为发酵剂在发酵虾酱中的应用提供理论依据。
相关新闻推荐
1、HK/RR11双组分系统调控变形链球菌生物膜形成与酸耐受性的机制研究(二)
2、明永冰川地区低温黄杆菌噬菌体生长曲线绘制及生物学特性(四)
