摘要:猫杯状病毒(FCV)作为导致猫上呼吸道感染的重要病原,具有高度传染性,严重危害猫科动物健康。为了解山西省FCV分离株变异水平及遗传发育特征,使用猫肾细胞(CRFK)分离、纯化山西省FCV分离株,用透射电镜观察病毒形态,测定病毒半数感染量(TCID50)和生长曲线,基于结构蛋白VP1分析猫杯状病毒基因、氨基酸变异水平与遗传发育特征。
猫杯状病毒病是由猫杯状病毒(feline calicivirus,FCV)引起的一种多发性传染病,主要引起猫的呼吸道疾病、口炎、关节炎和出血性发热等。FCV属于杯状病毒科、疱疹病毒属,是一种正二十面体对称的球形无囊膜病毒。近年来,多个国家报道猫杯状病毒为高致病性毒株(FCV virulent systemic disease,FCVVSD),引起猫的恶性全身性系统疾病且致死率高达50%,对猫及猫科动物造成了严重威胁。
FCV为RNA病毒,大小约7.7 kb,全基因组共有3个开放阅读框(open reading frame,ORF),其中ORF1编码7个非结构蛋白,ORF2编码主要结构蛋白VP1,ORF3编码次要结构蛋白VP2。衣壳蛋白VP1分为6个区域,分别为A、B、C、D、E和F区,A区位于1~124aa,是VP1前体被切割掉的VP1前导区;B区位于125~397 aa;C区、E区变异较大,分别位于398~401 aa和427~524 aa,可变区E含有主要的B细胞表位;F区位于525~668 aa,含有非中和抗原表位。
结构蛋白VP1的变异能够帮助FCV逃逸宿主的免疫应答,其中E区的5´高变区426~460 aa处存在4个线性表位,3´高变区490~520 aa处存在2个构象表位,是FCV的抗原变异决定簇。通过分析单克隆抗体逃逸突变体的序列,确定441、448、449和455处存在4个氨基酸突变。459和462位的两个氨基酸参与FCV与细胞受体fJAM-A结合,431和433位氨基酸的突变会导致FCV无法在体内复制。VP1为高变异度基因,是FCV系统发育分析的主要基因,也是FCV病原研究、疫苗研发的关键靶点。FCV疫苗已在全球范围内广泛使用,并在FCV感染防控中发挥巨大作用。但目前FCV感染率仍然很高,由于FCV基因组突变频繁发生,现有疫苗无法保护猫免受所有FCV毒株的感染。
近年来,FCV变异株不断出现,引起病猫严重的全身性疾病,因此明确FCV氨基酸变异与遗传发育特征对防治猫杯状病毒病至关重要,但目前缺乏山西省FCV特征及其遗传变异分析的研究。鉴于此,本试验分离、纯化FCV山西株,测定其病毒滴度和生长曲线,基于VP1基因阐明FCV山西株同源性及遗传进化水平,旨在为FCV病原及疫苗研究提供理论基础。
1材料与方法
1.1试验材料
细胞和病料猫肾细胞(crandell-rees felinekidney cell,CRFK)由山西农业大学动物医学学院病原与宿主互作实验室保存,病料收集自山西省FCV感染猫的鼻咽拭子。
1.2主要试剂
病毒基因组DNA/RNA提取试剂盒(DP315),北京天根生化科技有限公司;胰蛋白酶、50×TAE、琼脂糖和中性红指示剂、RNase-Free ddH2O,北京索莱宝生物科技有限公司;DNA marker,大连宝生物工程有限公司;胎牛血清(fetal bovine serum,FBS)、杜氏改良Eagle培养基(DMEM),美国Gibco公司;反转录试剂盒,南京诺唯赞生物科技有限公司。
1.3试验方法
1.3.1病毒的分离培养
采集FCV感染猫的鼻咽拭子,经磷酸盐缓冲液(phosphate buffer saline,PBS)稀释后以0.22μm滤器过滤,取1/10体积的上清液接种于单层的CRFK细胞培养2~3 d,盲传4代,出现80%细胞病变时,反复冻融细胞3次,取上清液收获病毒。
1.3.2噬斑纯化试验
取10倍稀释后的病毒液接种于单层CRFK细胞,感作2 h后加入2%低熔点琼脂糖和2×DMEM培养基预混液,凝固后将培养板倒置放入含5%CO2的37℃培养箱中培养,待细胞出现病变时滴加500μL中性红溶液继续培养4 h,用枪头挑取噬斑,进行下一轮纯化。
1.3.3病毒浓缩与纯化FCV感染CRFK细胞,反复冻融细胞3次,6 000 r·min-1离心30 min收集病毒液,使用0.22μm滤器过滤病毒液后加入搅拌器中,向搅拌器中分别加入PEG 8000和NaCl,使其终浓度分别为7%和3%。4℃、120 r·min-1过夜搅拌,4℃、8 000 r·min-1环境下离心60 min,弃上清,用适量PBS溶液(pH值为7.4)重悬沉淀。用PBS溶液(pH值为7.4)配制质量分数为55%、45%、35%和25%的蔗糖溶液,分别取2 mL依次加入超速离心管中,4℃环境下静置过夜。将重悬的病毒液加入蔗糖密度梯度离心管中,4℃环境以38 000 r·min-1离心4 h,收集离心管中各层液体,进行透析与浓缩。
1.3.4透射电镜观察
取1滴浓缩后病毒液置于含0.5%Formvar载膜铜网上,常温干燥后滴加等体积的1%磷钨酸溶液(pH值7.2)于铜网上负染1 min。用滤纸吸去多于染液,自然干燥后置于透射电子显微镜下观察。
2、结果
病毒生长曲线测定
FCV感染CRFK细胞,分别在第6、第12、第24、第36、第48、第60和第72小时收集细胞,冻融3次后离心取上清液,以10-1-10-10的稀释倍数接种于96孔板,每个稀释倍数做8个重复。
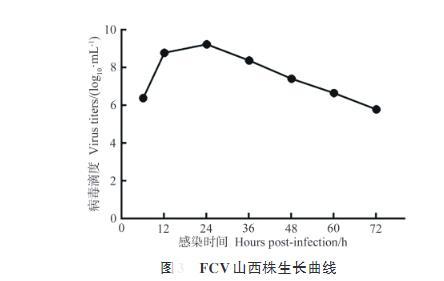
2 h后从培养箱中取出96孔板弃掉病毒液。PBS清洗细胞,每孔加入100μL 2%DMEM细胞维持液,置于培养箱中培养。观察细胞病变,计算不同感染时间下的TCID50,绘制生长曲线。
FCV生长曲线
根据96孔细胞培养板的病变情况,按照Reed-Muench两氏法计算出FCV山西株(SX-2021-3)TCID50为10-8.43/mL。比较FCV感染CRFK细胞不同时间段(6~72 h),发现SX-2021-3株在感染CRFK细胞24 h时病毒滴度达到最大。
结果显示,试验纯化得3株山西省FCV分离株(SX-2021-1、SX-2021-2和SX-2021-3),病毒大小约为40 nm,TCID50为10-8.43/mL,FCV感染CRFK细胞的6~72 h中,在24 h时病毒滴度达到最高(SX-2021-3)。SX-2021-1与SX-2021-2株的VP1基因同源性为99.8%,SX-2021-3株VP1基因呈现较高的变异性,与其他两株的同源性约为77%。FCV山西分离株与已公布FCV毒株同源性为70.7%~83.9%,其中SX-2021-1、SX-2021-2与我国黑龙江分离株(HRB-SS)同源性最高(83.9%),SX-2021-3与我国上海分离株(SH1)同源性最高(80.5%)。FCV山西分离株VP1蛋白在E区5′高变区和3′高变区均存在多个氨基酸位点突变,其中SX-2021-3株与其他两株的VP1蛋白氨基酸差异性明显。遗传进化分析结果显示,FCV山西分离株与疫苗株和VSD毒株亲缘关系均较远,SX-2021-1、SX-2021-2与我国黑龙江地区分离株(HRB-SS、WZ-1和XH)亲缘关系较近;SX-2021-3与上海毒株(SH1)处于同一分支。综上,本研究阐明了山西省FCV分离株变异水平及遗传发育特征,为FCV病原及疫苗研究提供了重要依据。
