研究简介:本论文主要就结核分枝杆菌(Mycobacterium tuberculosis,Mtb)如何在宿主体内适应低氧环境,并利用这一适应性来抑制宿主的免疫反应进行了研究。研究表明Mtb是一种非常成功的细胞内病原体,它在宿主巨噬细胞中生存,并在低氧的结核肉芽肿中形成。在这种低氧环境中,Mtb能够通过改变其代谢途径来抵抗宿主的免疫攻击。研究团队通过代谢组学、蛋白质组学和遗传学方法发现,在低氧条件下,Mtb能够诱导其磷血清氨酸转氨酶Rv0884c的表达,从而产生D-丝氨酸。这种D-丝氨酸的产生增加了Mtb在小鼠模型中的致病性,但它并不直接影响巨噬细胞内Mtb的生存。相反D-丝氨酸通过抑制CD8+T细胞产生IFN-γ,间接降低了巨噬细胞限制Mtb的能力。这一发现揭示了Mtb如何利用代谢产物来干预宿主的免疫反应。研究人员进一步探讨了D-丝氨酸抑制IFN-γ产生的机制。发现D-丝氨酸与WDR24蛋白相互作用,抑制了mTORC1的激活,这导致了T-bet表达的降低和IFN-γ产生的减少。T-bet是一种转录因子,对于CD8+T细胞产生IFN-γ至关重要。这项研究不仅提供了Mtb如何在低氧环境中生存的新见解,而且还揭示了Mtb如何通过代谢途径抑制宿主的适应性免疫反应。这些发现对于开发新的结核病治疗策略具有潜在的重要价值。
Bioscreen全自动生长曲线分析仪的应用
分枝杆菌在含有10%OADC、0.05%Tween-80和所需抗生素的7H9肉汤中生长至对数中期。使用Bioscreen C生长曲线仪器)和具有100个孔的蜂窝板测定每种菌株的生长曲线。简而言之将200μl每种细菌悬浮液调整至相似密度,添加到每个孔中,并在37°C下振荡培养H37Rv。每天测量OD 590。通过用50μl石蜡油覆盖每个培养物来建立缺氧条件。H37Rv培养物在37°C下孵育14天。进行了三次独立实验,每个实验一式三份。
实验结果
Mtb在低氧环境下通过诱导Rv0884c(一种磷酸丝氨酸转氨酶)的表达增加D-丝氨酸的产生,这一过程对于Mtb在宿主体内的致病性至关重要。D-丝氨酸的产生并不直接影响Mtb在巨噬细胞内的生存,而是通过抑制CD8+T细胞产生IFN-γ来间接影响巨噬细胞限制Mtb的能力。机制上,D-丝氨酸与WDR24蛋白相互作用,抑制了mTORC1的激活,导致T-bet表达下降和IFN-γ产生减少,从而抑制了CD8+T细胞的效应功能。通过遗传和药理学方法抑制Rv0884c或D-丝氨酸的活性,可以增强CD8+T细胞的免疫反应,减少Mtb在宿主体内的存活和致病性。
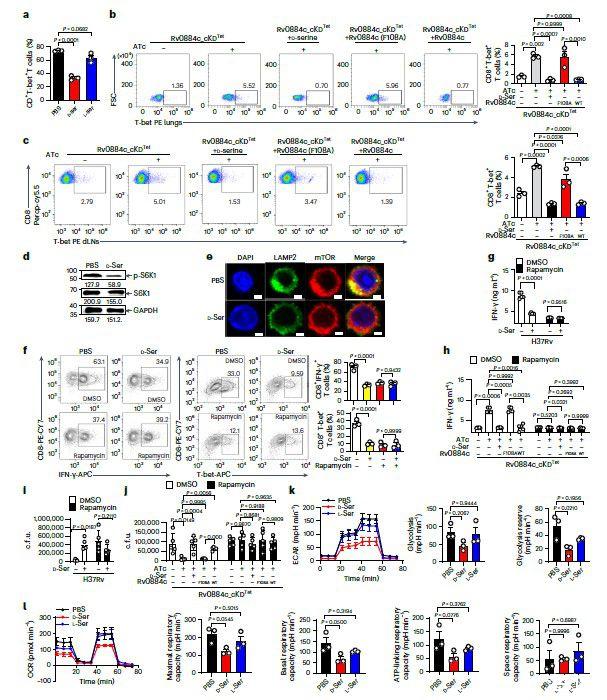
图1、a,通气或缺氧条件下孵育14天的H37Rv差异分泌的部分代谢物的热图(左)和相对面积(右)。b,来自在通气和缺氧下孵育指定天数的H37Rv培养物上清液的D-丝氨酸浓度的测定。c,通气或缺氧14天的H37Rv细胞裂解物的蛋白质组学分析中丝氨酸代谢相关蛋白的倍数变化。d,来自在通气和缺氧下孵育的H37Rv的细胞裂解物的免疫印迹(IB)。使用ImageJ对Rv0884c和SigA蛋白的水平进行定量,并在印迹下方显示。来自在通气和缺氧下与或不与ATc一起孵育指定天数的Rv0884c_cKD Tet菌株的培养物上清液中的e,D-丝氨酸浓度。f、g、qPCR分析来自感染H37Rv(f)或Rv0884c_cKD Tet菌株的BMDM的Rv0884c mRNA,经DMSO或ATc(g)处理并在正常空气(-)或95%O 2(O 2)条件下孵育指定的时间。h、i、D-丝氨酸浓度,来自感染H37Rv或Rv0884c_cKD Tet菌株的iBMDM的培养物上清液(h)或细胞裂解物(i),与或不与ATc一起孵育指定时间。nd,未检测到。j–o,C57BL/6小鼠用GFP-H37Rv(j,k,m)、H37Rv(l)或Rv0884c_cKD Tet气雾感染,然后用或不用多西环素(n,o)喂养4周。受感染的小鼠在处死前暴露于95%O 2或正常空气中20小时。NC,未感染的小鼠。对PIMO(红色)、H37Rv(绿色)、F4/80(粉色)和DAPI(蓝色)进行肺免疫荧光染色。使用ImageJ(j)量化PIMO的平均荧光强度(MFI)。分析肺匀浆(k,o)和血清(l–n)上清液中的D-丝氨酸浓度。p、q、C57BL/6小鼠用指定的Mtb菌株气溶胶感染4周。分析血清(p)和肺匀浆上清液(q)中的D-丝氨酸浓度。
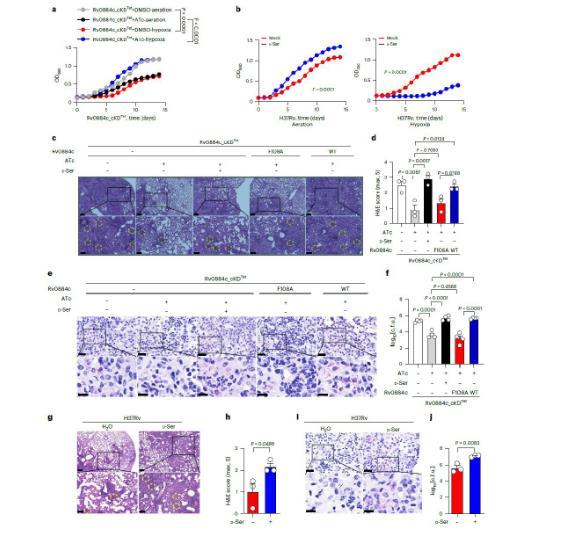
图2、a,Rv0884c_cKD Tet在有或没有ATc的情况下在37℃通气或缺氧条件下培养14天的体外生长曲线。b,添加10 mM D-丝氨酸的H37Rv在37℃通气(左)或缺氧(右)条件下孵育14天的体外生长曲线。c–f,C57BL/6小鼠气溶胶感染每只小鼠约200 cfu的Rv0884c_cKD Tet(含或不含ATc)、Rv0884c_cKD Tet(含ATc和D-丝氨酸)、Rv0884c_cKD Tet+Rv0884c(F108A)(含ATc)和Rv0884c_cKD Tet+Rv0 884c与ATc。感染4周后,通过H&E染色(c;比例尺,200μm(顶部)和100μm(底部))、组织学评分(d)、抗酸染色(e;比例尺,200μm(顶部)和100μm(底部))评估感染小鼠肺切片的组织病理学。比例尺,20μm(顶部)和10μm(底部))和细菌负载(f)。使用黄色虚线圆圈标记不同条件之间的白细胞浸润区域。g–j,C57BL/6小鼠用每只小鼠约200 cfu的H37Rv气雾感染,然后通过饮用水向一半受感染的小鼠施用30 g l-1 D-丝氨酸。感染4周后,通过H&E染色(g;比例尺,200μm(顶部)和100μm(底部))、组织学评分(h)、抗酸染色(i;比例尺)评估感染小鼠肺切片的组织病理学。比例尺,20μm(顶部)和10μm(底部))和细菌负载(j)。使用黄色虚线圆圈标记不同条件之间的白细胞浸润区域。
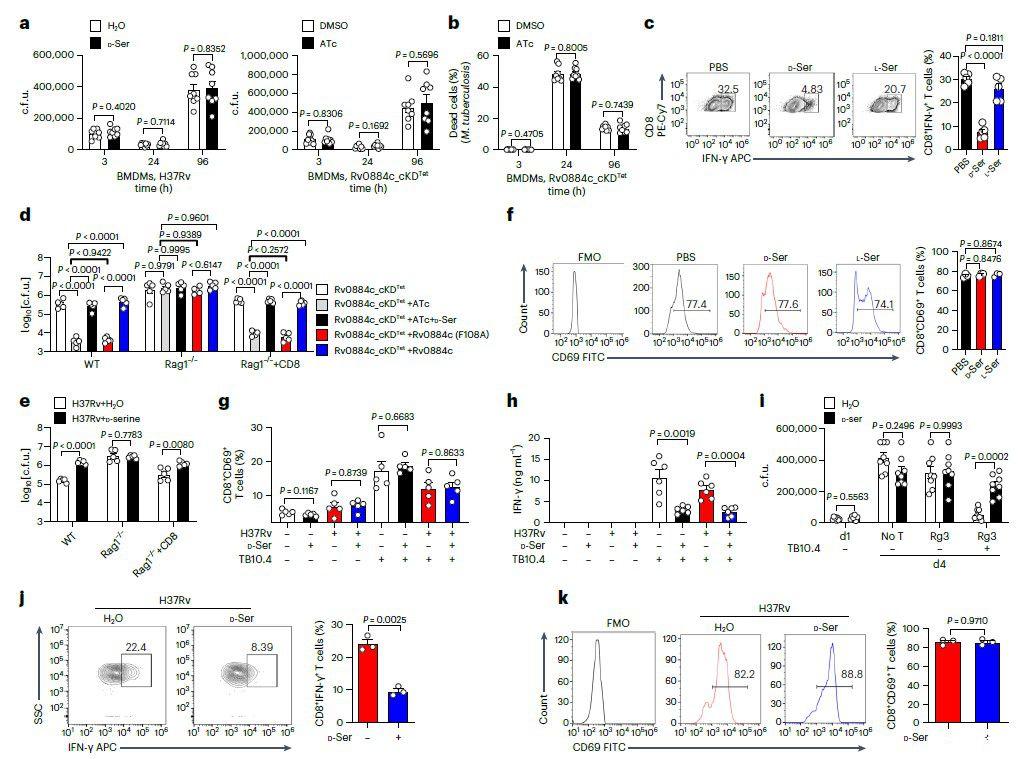
图3、a,使用cfu测定评估用或不用D-丝氨酸(10mM)处理的BMDM中的H37Rv(左)或用或不用ATc处理的BMDM中的Rv0884c_cKD Tet(右)的细胞内存活。b,使用LIVE/DEAD BacLight细菌活力试剂盒测定BMDM中用或不用ATc处理的Rv0884c_cKD Tet的细菌活力。c,f,在IL-2和IL-12 p70存在下用抗CD3和抗CD28抗体激活和分化幼稚CD8+T细胞5天,并用PBS、D-丝氨酸或L-丝氨酸处理。测定了IFN-γ+(c)和CD69+(f)CD8+T细胞的百分比。APC,别藻蓝蛋白。d、e、WT小鼠、Rag1−/−小鼠和Rag1−/−过继转移CD8+T细胞(Rag1−/−+CD8)的小鼠,用约200 cfu的指定Mtb菌株气溶胶感染(d、Rv0884c_cKDTet和或无ATc、Rv0884c_cKDTet+Rv0884c(F108A)与ATc、以及Rv0884c_cKDTet+Rv0884c与ATc;e、H37Rv)或用D-丝氨酸处理。使用cfu测定确定感染后4周肺组织中的细菌负荷。g,将H37Rv感染的BMDM(MOI=5)和用或不用D-丝氨酸处理的活化的TB10Rg3 T细胞共培养2小时后,测量TB10Rg3 T细胞中CD69+TB10Rg3 T细胞的百分比。h,将H37Rv感染的BMDM(MOI=5)和用或不用D-丝氨酸处理的活化的TB10Rg3 T细胞共培养3天后,使用ELISA测量IFN-γ的表达。i,感染Mtb菌株1天后,将BMDM与用或不用D-丝氨酸处理的活化TB10Rg3 T细胞共孵育3天,并测定感染1或4天的BMDM中的细胞内cfu。无T,未脉冲的BMDM组感染H37Rv 4天,未与T细胞共孵育;d1,感染H37Rv 1天且未与T细胞共孵育的未脉冲BMDM组;d4,感染H37Rv 4天的BMDM组;Rg3,用H37Rv感染4天并与TB10Rg3 T细胞共孵育的脉冲或非脉冲BMDM组。j、k、C57BL/6小鼠用每只小鼠约200 cfu的H37Rv气雾感染,并给予D-丝氨酸4周。测量肺组织中IFN-γ+(j)和CD69+(k)CD8+T细胞的百分比;FMO用作对照
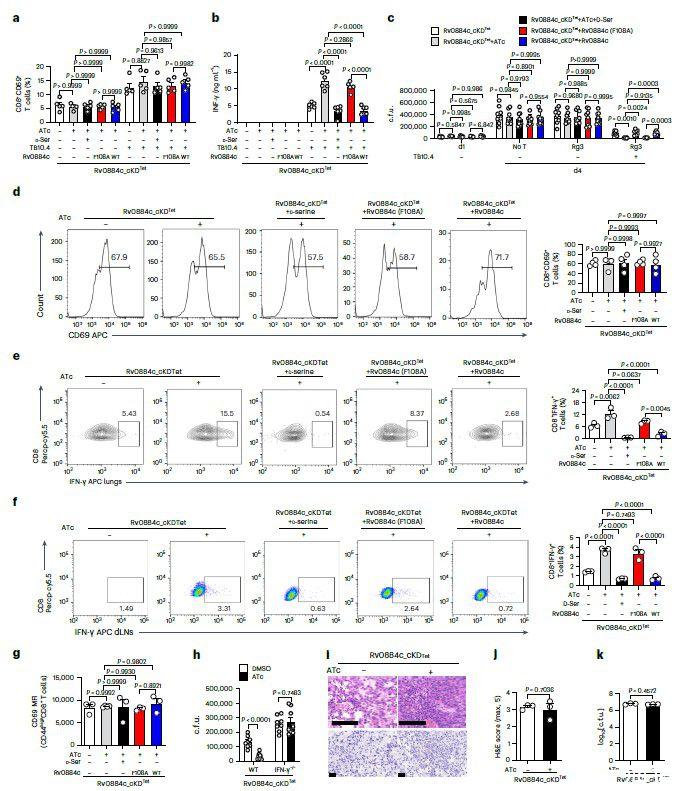
图4、a)将特定Mtb菌株感染的骨髓来源的树突状细胞(BMDMs,MOI=5)与激活的TB10Rg3 T细胞共培养2小时后,测量TB10Rg3 T细胞中CD69阳性细胞的百分比。CD69是一种激活标志物,用于评估T细胞的激活状态。b)将特定Mtb菌株感染的BMDMs与激活的TB10Rg3 T细胞共培养3天后,使用酶联免疫吸附试验(ELISA)测量干扰素-γ(IFN-γ)的表达。IFN-γ是一种重要的细胞因子,通常在免疫反应中由T细胞产生。c)在Mtb菌株感染1天后,将BMDMs与激活的TB10Rg3 T细胞共孵育3天,并确定感染1天或4天后BMDMs内细胞内的菌落形成单位(c.f.u.)。d-g)使用气溶胶方式感染C57BL/6小鼠,每只小鼠约200个菌落形成单位的Rv0884c_cKDTet,有无ATc(四环素诱导剂),Rv0884c_cKDTet与ATc和D-丝氨酸(30g/L),v0884c_cKDTet+Rv0884c(F108A)与ATc,以及Rv0884c_cKDTet+Rv0884c与ATc。感染4周后,检测以下指标:CD69+CD8+T细胞的百分比(d);肺组织中CD8+IFN-γ+T细胞的百分比(e),或从引流淋巴结(dLNs)中(f);以及肺组织中CD44high CD8+T细胞的CD69平均荧光强度(MFI)(g)。h)将肽(TB10.44–11)脉冲处理的BMDMs感染Rv0884c_cKDTet,有无ATc处理1天,然后与体外分化的CD8+T细胞共培养3天,这些T细胞来自C57BL6小鼠或CD4CreIfngfl/fl小鼠的脾脏。感染4天后测量细菌负荷。i-k)CD4CreIfngfl/fl小鼠通过气溶胶方式感染Rv0884c_cKDTet,有无ATc,每只小鼠约200个菌落形成单位,持续4周。通过苏木精-伊红(H&E)染色(i,顶部;比例尺,100μm)、抗酸染色(i,底部;比例尺,20μm)评估感染小鼠肺组织的组织病理学,以及组织学评分(j)和细菌负荷(k)。
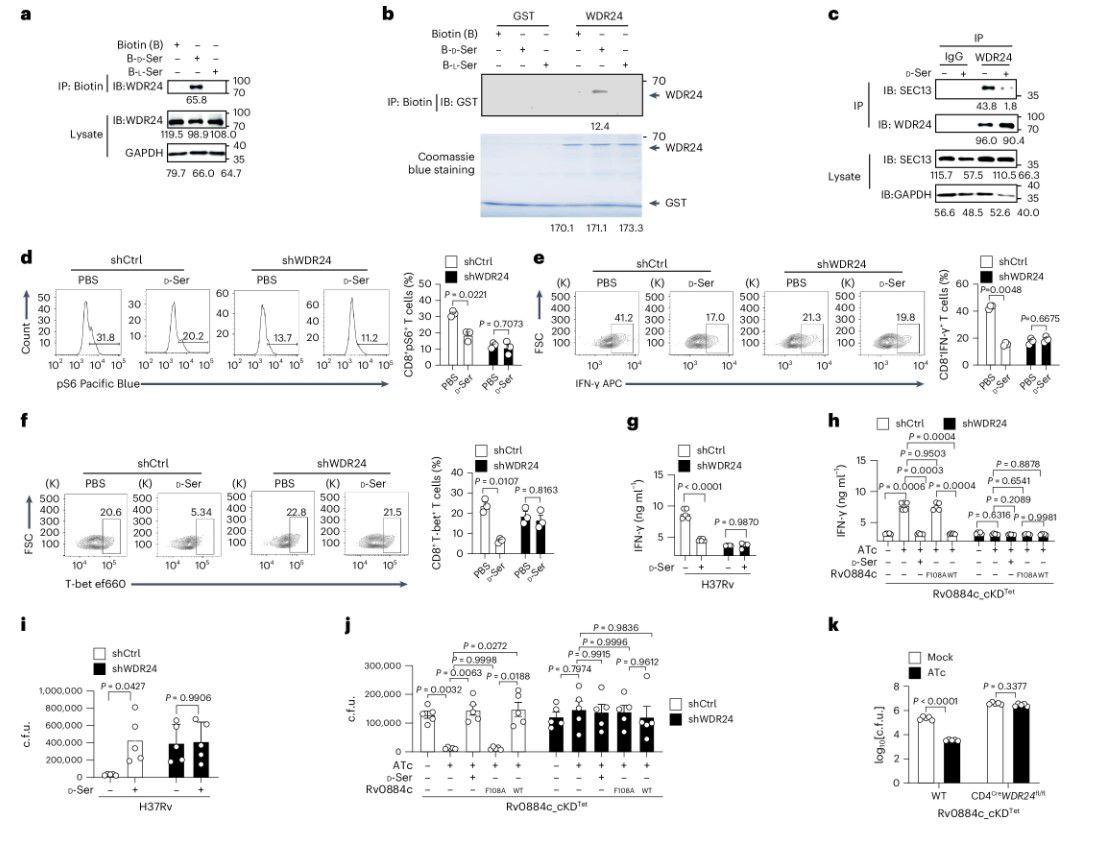
图5、a,进行Co-IP以检测T细胞中D-丝氨酸和WDR24之间的相互作用。印迹下方的值表示使用ImageJ进行的光密度定量。b,使用体外GST Pull-down测定检测D-丝氨酸与WDR24的直接相互作用。印迹下方的值表示使用ImageJ进行的光密度定量。c,进行Co-IP以检测WDR24与GATOR2(SEC13)的其他成分的相互作用,该相互作用被D-丝氨酸中断。印迹下方的值表示使用ImageJ进行的光密度定量。d–f,WDR24敲低CD8+T细胞用PBS或D-丝氨酸处理。使用FACS分析WT CD8+T细胞或WDR24敲低CD8+T细胞中S6(d)的磷酸化、T-bet(e)和IFN-γ(f)的表达。g,i,感染H37Rv(MOI=5)1天的BMDM与TB10Rg3 T细胞或用或不用D-丝氨酸(10 mM)处理的WDR24敲低TB10Rg3 T细胞共同孵育另外3天。ELISA法检测IFN-γ的表达(g);确定了BMDM中的细胞内CFU(i)。h,j,BMDMs用指定的Mtb菌株(MOI=5)感染1天,并与TB10Rg3 T细胞或WDR24敲低TB10Rg3 T细胞共孵育3天。采用ELISA法检测IFN-γ的表达(h);测定了BMDM中的细胞内CFU(j)。k,CD4 Cre WDR24 fl/fl小鼠用每只小鼠约200 cfu的Rv0884c_cKD Tet气雾感染,用或不用ATc治疗4周。使用cfu测定法测定肺组织中的细菌负荷。
总结
适应缺氧是结核分枝杆菌(Mtb)在体内生存的主要挑战。产生干扰素(IFN)-γ的CD8+T细胞有助于控制结核分枝杆菌感染,部分是通过促进巨噬细胞的抗菌活性。结核分枝杆菌是否会对抗这些反应,特别是在缺氧条件下,目前仍不清楚。利用代谢组学、蛋白质组学和遗传学方法,研究人员证明Mtb诱导Rv0884c(SerC)(一种Mtb磷酸丝氨酸转氨酶)产生D-丝氨酸。这种活性增加了小鼠中Mtb的发病机制,但并不直接影响巨噬细胞内Mtb的存活。相反D-丝氨酸抑制CD8+T细胞产生IFN-γ,从而间接降低了巨噬细胞在共培养时限制Mtb的能力。从机制上讲,D-丝氨酸与WDR24相互作用并抑制CD8+T细胞中mTORC1的激活。这降低了CD8+T细胞的T-bet表达并减少了IFN-γ的产生。研究结果表明结核分枝杆菌逃避机制,其中病原体对缺氧的代谢适应导致适应性抗结核免疫的氨基酸依赖性抑制。本研究提供了提供了Mtb如何在低氧环境中生存的新见解,而且还揭示了Mtb如何通过代谢途径抑制宿主的适应性免疫反应。这些发现对于开发新的结核病治疗策略具有潜在的重要价值。
相关新闻推荐
2、鼠李糖乳杆菌Probio-M9连续传代培养过程中稳定性评价(一)
3、3种植物精油对调理牛排腐败贮藏过程优势腐败菌生长抑制情况及细菌生长曲线(二)
