2结果与分析
2.1菌株Q2对尖镰孢菌SG-15生长发育的影响
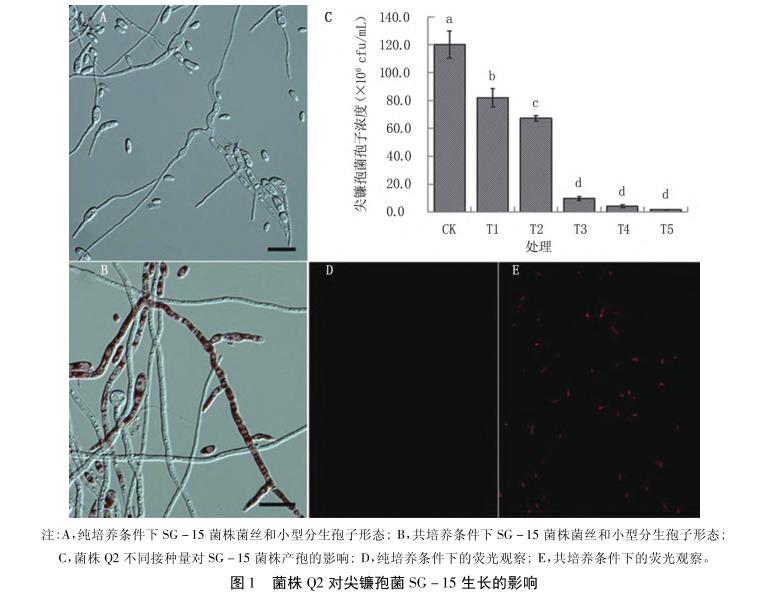
显微镜下观察发现,单独培养的SG-15菌丝生长正常,产生了较多的小型分生孢子,有些孢子已经萌发;在菌株Q2与菌株SG-15共培养体系中SG-15菌丝形态发生显著变化,菌丝细胞肿胀呈圆形,菌丝细胞间缢缩,菌丝细胞内油球增多,菌丝内出现红色物质,仅产生了较少的小型分生孢子,未见孢子萌发。在共培养试验中,菌株SG-15小型分生孢子在体系中的起始浓度约为2.0×106cfu/mL,在共培养5 d后,T1~T5共培养体系中的菌株SG-15小型分生孢子浓度显著低于对照处理(CK)。CK处理中菌株SG-15的孢子浓度为1.20×108cfu/mL,T1、T2、T3、T4和T5处理分别为8.20×107、6.73×107、9.83×106、4.33×106cfu/mL和1.77×106cfu/mL。PI染色结果表明,与对照处理相比,共培养体系中荧光强度显著增强,说明PI染料可以透过受损的细胞膜进入细胞,菌株SG-15分生孢子的细胞壁和细胞膜受损。

2.2菌株Q2的转录组分析
在Control和FOM处理的6个转录组测序文库中,获得36 818万条Reads,去除带接头、低质量的Reads后,总共获得超过34 397万个高质量的Reads。所有样本的Q30值均大于92%。这些数据表明,RNA-seq获得的数据质量可用于进一步的分析。在样本Control的测序文库中,97.76%的序列比对到菌株Q2的基因组中(NCBI登录号:JABUIS000000000),每个样本中超过98%的序列被唯一地定位到基因组上。在样本FOM的测序文库中,55.45%的序列比对到菌株Q2的基因组中,每个样本中超过97%的序列被唯一地定位到基因组上。在菌株SG-15诱导下,菌株Q2的基因表达发生显著变化,共有2 664个差异表达基因,占总基因的28.14%,其中1 302个基因上调、1 362个基因下调。
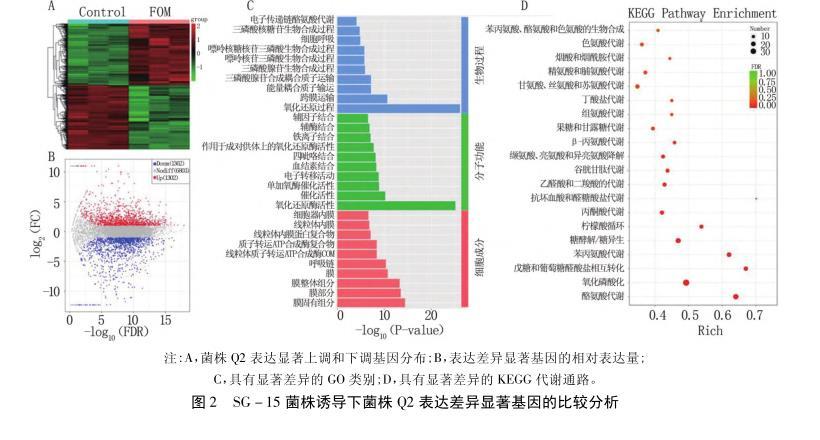
通过GO(gene ontology)分析和KEGG代谢通路分析对差异基因在注释功能中的分布状况进行了分析。GO分析将基因划分为分子功能(molecular functions)、生物过程(biological processes)和细胞成分(cellular components)。在分子功能分类中,差异表达基因(DEGs)主要富集于氧化还原酶活性(oxidoreductase activity,238个基因上调、218个基因下调)和催化活性(monooxygenase activity,34个基因上调、59个基因下调)。在生物过程类别中,差异表达基因主要富集于氧化还原过程(oxidation-reduction process,2 155个基因上调、220个基因下调)和跨膜运输(transmembrane transport,161个基因上调、127个基因下调)。在细胞成分类别中,差异表达基因主要富集于膜固有组分(intrinsic component of membrane,164个基因上调、159个基因下调)、膜部分(membrane part,187个基因上调、162个基因下调)和膜整体组分(integral component of membrane,161个基因上调、152个基因下调)。由GO分析可知,菌株Q2氧化还原过程及氧化还原酶活性和催化活性较为活跃。
DEGs被注释到111条代谢通路中,共获得显著富集代谢通路27条,主要为酪氨酸代谢(tyrosine metabolism,17个基因上调、8个基因下调)、氧化磷酸化(oxidative phosphorylation,35个基因上调、1个基因下调)、戊糖和葡萄糖醛酸盐相互转化(pentose and glucuronate interconversions,14个基因上调、2个基因下调)、苯丙氨酸代谢(phenylalanine metabolism,11个基因上调、7个基因下调)、糖酵解/糖异生(glycolysis/gluconeogenesis,20个基因上调、3个基因下调)、柠檬酸循环(citrate cycle,13个基因上调、1个基因下调)、丙酮酸代谢(pyruvate metabolism,9个基因上调、7个基因下调)。这些结果表明,在尖镰孢菌SG-15诱导下,菌株Q2具有更加活跃的营养物质代谢和能量代谢。
2.3尖镰孢菌诱导下菌株Q2几丁质酶和葡聚糖酶相关基因表达
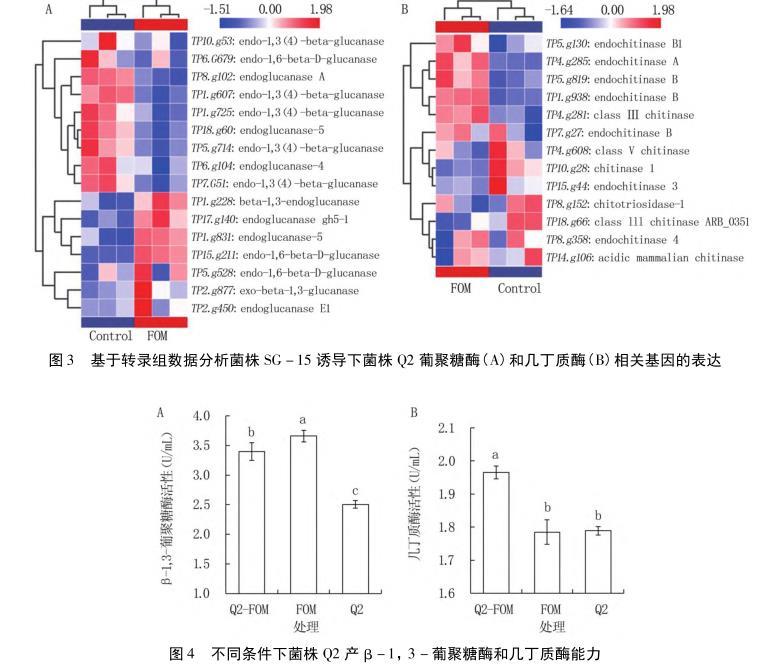
菌株Q2基因组中共计预测和注释到9 600个编码基因,其中在碳水化合物活性酶数据库(CAZy)中注释到463个碳水化合物活性酶基因,占总基因数的4.8%,包括200个糖苷水解酶(glycoside hydrolases,GHs)、83个糖基转移酶(glycosyl transferases,GTs)、2个多糖裂解酶(polysaccharide lyases,PLs)、84个碳水化合物酯酶(carbohydrate esterases,CEs)、79个辅助活性酶(auxiliary activities,AAs)和15个碳水化合物结合酶(carbohydrate-binding modules,CBM)。在糖苷水解酶的基因中注释到30个葡聚糖酶(glucanase)基因和23个几丁质酶(chitinase)基因。结合菌株Q2基因组在SwissProt数据库的注释结果,筛选到了16个葡聚糖酶基因和13个几丁质酶基因。为研究菌株Q2与尖镰孢菌菌株SG-15互作过程中葡聚糖酶和几丁质酶相关基因表达差异,根据转录组数据的FPKM值作为基因的相对表达量构建了基因表达热图。在菌株SG-15诱导下,菌株Q2的几丁质酶和葡聚糖酶相关基因表现出不同的表达趋势,其中β-1,3-葡聚糖酶基因(TP1.g228、TP2.g877)和几丁质酶(TP1.g938、TP4.g281、TP4.g285、TP5.g130、TP5.g819)的表达水平上升。在菌株Q2和菌株SG-15共培养体系中,β-1,3-葡聚糖酶和几丁质酶活性分别为3.40 U/mL和1.97 U/mL,相比于菌株Q2纯培养体系中的β-1,3-葡聚糖酶活性(2.51 U/mL)和几丁质酶活性(1.79 U/mL)提高了35.46%和10.06%。
2.4尖镰孢菌SG-15诱导下菌株Q2的次级代谢产物相关基因的表达
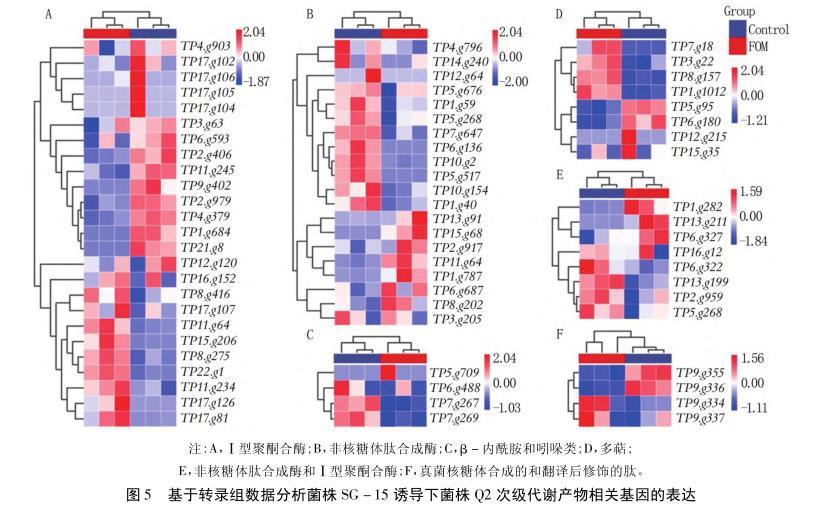
基于antiSMASH数据库,在Q2基因组中预测到57个次级代谢物簇、66个核心生物合成基因(core biosynthetic genes),主要包括Ⅰ型聚酮合酶(T1PKS)、非核糖体肽合成酶(NRPS)、β-内酰胺(beta-lactone)、吲哚类(indole)、多萜(terpene)、真菌核糖体合成的和翻译后修饰的肽(fungal-RiPP)。根据FPKM值构建的基因表达热图显示,在菌株SG-15诱导下,菌株Q2的次级代谢产物相关基因表现出不同的表达趋势,其中TP1.g1012(pentalenene synthase)、TP7.g18(terpene synthase)、TP8.g157(trichodiene synthase)、TP8.g275(polyketide synthase)、TP11.g64(nonribosomal peptide synthetase)和TP17.g126(polyketide synthase)等基因的表达水平显著提高(P<0.05)。进一步对以TP17.g126为核心生物合成基因的次级代谢产物簇相关基因进行分析发现,以TP17.g126为核心的次级代谢产物簇包括13个基因,其中8个基因的表达水平在SG-15菌株诱导下显著提升,经qRT-PCR验证表明,TP17-124、TP17-125、TP17-126、TP17-127、TP17-128、TP17-129、TP17-130和TP17-131分别提高9.12、8.68、96.68、30.67、31.88、4.53、22.74、8.41倍。但尚未明确TP17.g126基因参与合成的次级代谢产物对SG-15菌株生长的影响。
相关新闻推荐
1、荧光假单胞菌JL1对菌丝分泌物生长反应及对N2O排放的影响
2、益生菌靶向肠道微生物群,改善血脑屏障及其相关疾病的研究(三)
