奇异变形杆菌是医院感染,特别是尿路感染中非常重要的病原体之一。由于其对多粘菌素和替加环素(治疗CRE“三剑客”之二)的固有耐药,碳青霉烯耐药奇异变形杆菌的的出现尤为令人关注;特别是那些产生金属酶NDM-1的菌株,使临床治疗极其困难。
NDM-1的传播是是全球公共健康面临的一项重大挑战。blaNDM-1基因在多种遗传背景中被发现,但最常与可移动的遗传元件有关。整合接合元件(Integrating Conjugative Element,ICE)是一种可自我传播的移动遗传元件,能够从宿主染色体上切除,形成可通过接合转移到受体细菌的环形中间体。ICE已被证明与临床上重要的耐药基因的广泛传播有关。
研究过程早在2015年,我们在杭州一家医院ICU的一个尿路感染患者分离到一株奇异变形杆菌(命名为XH1653),该菌株除了氨曲南外对所有受试的抗菌药物均耐药(这种表型提示该菌株可能含有金属酶)。全基因组数据显示,大多数耐药基因聚于一簇,且含有双拷贝的碳青霉烯耐药基因blaNDM-1(图1),最后通过分析发现其实这些耐药基因均位于一个新型SXT/R391家族ICE中(命名为ICEPmiChnXH1653)。

图1 BacAnt:细菌DNA序列的组合注释服务器,用于识别抗生素抗性基因、整合子和转座元件
研究结果BLAST分析结果显示,该ICE与北京分离到的奇异变形杆菌中的ICEPmiCHN905相似,只在可变区VRIII和高频插入位点区HS4两个区域中存在差异;HS4区大约有73.75 kb大,拥有19个耐药基因,是由ISPpu12复合转座子介导形成(两端有转座标志TSD序列),与分离自四川的一株奇异变形杆菌中发现的ICEPmiBCP11中的HS4高度同源,最主要的差别是我们的ICE拥有floR基因和blaNDM-1基因,而blaNDM-1则由ISCR1复合转座子介导并形成串联拷贝(图2)。blaNDM-1的遗传环境与已报道的携带blaNDM-1的奇异变形杆菌PM58质粒和大肠杆菌Y5染色体相同。这是首次在奇异变形杆菌中的ICE发现了多拷贝blaNDM-1。
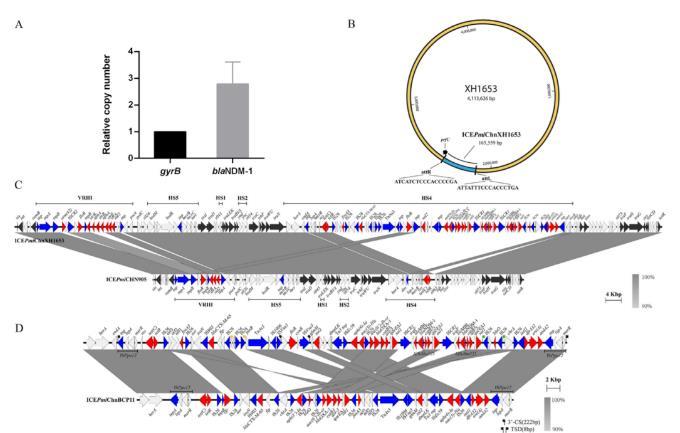
图2携带双拷贝NDM-1的奇异变形杆菌XH1653的基因型特征
除了序列分析之外,我们继续对该ICE的生物学特征进行了详细研究。我们通过PCR检测到ICEPmiChnXH1653环状中间体的存在,接合实验表明该ICE可以转移到大肠埃希菌EC600中,接合效率为1.5×10−7,与供体株相比,受体株的ICE具有更高的切除频率和染色体外拷贝数。我们还观察到ICEPmiChnXH1653的存在会对宿主细菌的适应性产生负面影响,并导致宿主转录组的变化(图3)。
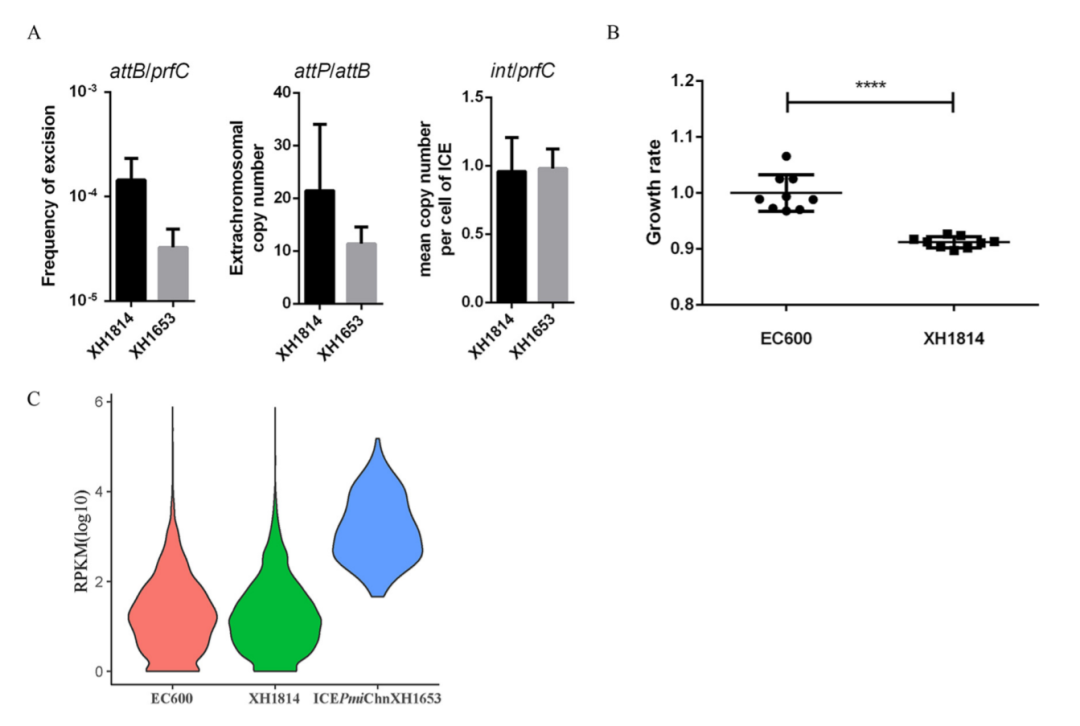
图3 ICEPmiChnXH1653的生物学特性。XH1814为接合子(拥有ICEPmiChnXH1653的EC600)
为了探索ICE带给宿主负担的相关补偿机制,我们进行了体外传代实验,然而由于对照菌株EC600本身也产生了适应性进化,因此无法确定相关突变是针对ICE负担产生的。然而,在无抗菌药物压力条件下的体外进化实验和基因组数据表明,双拷贝的碳青霉烯耐药基因blaNDM-1所在的ISCR1转座子片段以及氯霉素耐药基因floR所在的ISVsa3转座子片段在连续传代过程中能够发生丢失(图4),使得宿主细菌恢复了对碳青霉烯类抗菌药物的敏感性,证实ICEPmiChnXH1653通过ISCR1介导的滚环传播机制进行同源重组获得碳青霉烯酶基因。
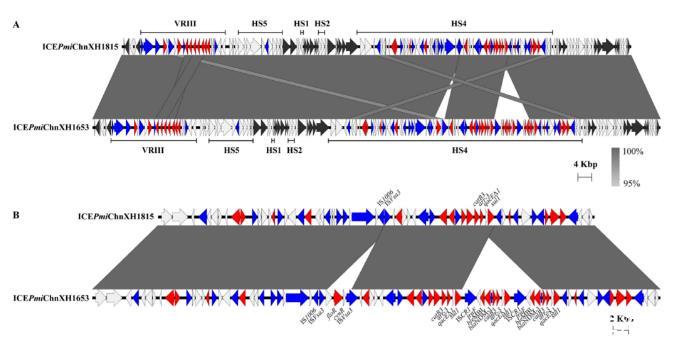
图4 ICEPmiChnXH1815的遗传结构。XH1815为XH1814传代后发生NDM-1丢失的菌株。
结论我们首次报道携带两个blaNDM-1串联拷贝的新型SXT/R391家族ICE,同时也说明了该ICE作为耐药基因积累和传播平台的重要作用。此外,ISCR1转座子或ICE对blaNDM-1的传播可能是导致碳青霉烯类抗菌药物跨物种耐药的重要因素。
相关新闻推荐
1、不同锌浓度下菌株Ⅳ8R3、Ⅱ2R3的生长曲线及玉米生长和锌积累的影响(一)
2、纳米ZnO-Ag复合材料对小麦根腐菌菌丝生长、种子萌发和幼苗生长影响(二)
3、鸡大肠埃希氏菌裂解性噬菌体一步生长曲线、生物学特征及全基因组测序(三)
