采用4种不同浓度的抗生素对(氨苄青霉素(Amp)、卡那霉素(Kan)、氯霉素(Cmp)及四环素(Tet))莱茵衣藻(Chlamydomonasreinhardtii)进行无菌化处理,研究抗生素种类及浓度对莱茵衣藻的细胞密度、叶绿素a含量及光化学活性的影响,以确定对莱茵衣藻细胞无害并能抑制伴杂菌生长的抗生素种类及使用浓度。结果表明:低于100μg/mL的氨苄青霉素(Amp)及20μg/mL的氯霉素(Cmp)处理,会使莱茵衣藻的细胞密度及叶绿素a的含量增加,卡那霉素(Kan)及四环素(Tet)各浓度的处理都会使细胞密度及叶绿素a的含量下降,并呈现抗生素的剂量依赖效应;50μg/mL的Amp及10μg/mL的Cmp在处理3 d后会增加莱茵衣藻的实际光合效率(YII)及相对电子传递效率(rETR),而后下降;Kan及Tet各浓度的处理都会使YII及rETR显著下降。结合4种抗生素对莱茵衣藻伴生菌的抑菌实验结果,表明在4种抗生素中,Cmp在抑菌范围内并不会明显地抑制莱茵衣藻细胞的生长与光化学活性,可用于莱茵衣藻细胞无菌化培养中。
莱茵衣藻(Chlamydomonasreinhardtii)隶属于绿藻门、团藻目、衣藻属,为低等的具鞭毛单细胞水生植物,广泛分布在海洋、江河、湖泊等水域,通过光合作用获得能量,也可以在有碳源的完全黑暗的环境中生长。高度的适应性、快速的传代能力及其至关重要的代谢途径使得莱茵衣藻成为生物学研究领域的模式生物,常被用作研究真核生物鞭毛的组装、基体功能及功能障碍等病理效应的模型。莱茵衣藻所含有的核、叶绿体及线粒体三套基因组,目前均已完成了测序,极大地促进了藻类代谢、叶绿体生物起源、光合作用机制、营养元素胁迫以及产氢等方面的研究。
微藻的无菌培养和保存是研究微藻生理、生化、营养、药理学及毒理学等必不可少的步骤之一,也是基础和关键环节。在微藻培养过程中,由于藻种常伴有杂藻或杂菌,而无法准确进行藻间或藻菌相互作用、兼养和异养等方面的研究。抗生素可抑制水生细菌的繁殖,在除菌、抑菌方面表现出了强大作用,利用微藻比杂菌具有对抗生素更强的耐受性,选择使用一种或多种抗生素进行无菌处理则较容易获得无菌藻系。如孙雯等采用了8种常用抗生素对雨生红球藻(Haematococcuspluvialis)进行无菌化处理,结果表明:在培养前期加入灰黄霉素的抑菌效果最好,且对雨生红球藻细胞的生长抑制最小;培养中后期添加青霉素的抑菌效果较明显;混合使用灰黄霉素和青霉素时抑菌效果明显优于使用单一抗生素。目前,国内外有关微藻无菌化培养及对抗生素敏感性研究的报道相对较少,主要集中在绿藻、颤藻、螺旋藻及紫球藻等方面。
本研究中,笔者根据抗生素在抗菌机制和抗菌谱上的差别,选择了常用的4种抗生素,氨苄青霉素(ampicillin,Amp)、卡那霉素(kanamycin,Kan)、氯霉素(chloramphenicol,Cmp)及四环素(tetracycline,Tet)应用于莱茵衣藻的培养中,通过生长曲线、叶绿素a含量、光化学活性等指标来探究每种抗生素的存在浓度与莱茵衣藻的生长和光化学活性之间的联系,确定分离及纯化莱茵衣藻时对藻细胞无害、同时又能抑制伴生杂菌生长的抗生素种类及浓度,以期为莱茵衣藻无菌系的建立提供理论支持。
1材料与方法
1.1藻种及培养
莱茵衣藻(C.reinhardtii)购自中国科学院野生生物种质库,使用TAP(tris acetate phosphate)液体培养基,其成分按文献配制,培养温度为(25±1)℃,光照强度为60μmol/(m·s),光暗时间比为12∶12。培养过程中每天摇动培养瓶数次,防止微藻附壁下沉,待进入指数生长期时,将其按5×105个/mL的密度接种后,用抗生素处理,然后测定分析微藻的相关生理指标。在藻种传代培养过程中,严格按照无菌操作规程进行,细菌培养使用LB固体培养基。
1.2实验方法
1.2.1藻细胞密度测定
将4种抗生素分别加入到处于指数生长期的莱茵衣藻藻液中,各抗生素的终浓度分别设定4个梯度(表1),以未加入抗生素的藻液作为对照组。采用血球计数板计数,每天定时吸取少量摇匀的藻液,置于视野为40×10倍的光学显微镜下观察,记录藻细胞总数。
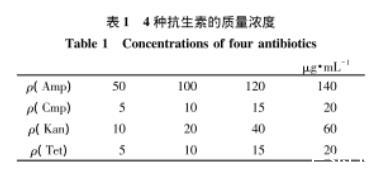
表1 4种抗生素的质量浓度
1.2.2叶绿素a含量的测定
4种不同浓度的抗生素处理指数生长期的藻液时,每天每个处理组各取5 mL的藻液,以6 000 r/min离心10 min,去除上清液后,将藻细胞用90%丙酮在黑暗条件下提取2次,每次24 h,最后将提取液定容至10 mL,使用紫外分光光度计在750、663、645和630 nm下测定吸光度。
1.2.3叶绿素荧光参数的测定
利用多激发波长调制叶绿素荧光仪(德国,Walz)测定藻细胞的光化学活性。不同种类及浓度的抗生素处理后,每天取样,测定荧光参数。检测过程如下:首先将处于指数生长期的莱茵衣藻培养液黑暗处理12 h,然后取2 mL藻液加入石英杯中,设置检测光(measure light,ML)波长为440 nm,并将实时荧光(current fluorescence level)Ft调至1.5,运行脚本sigma 500 chl并进行O-I1拟合,保存莱茵衣藻光学截面积数据,在sp-analysis模式下进行快速光曲线测定,将保存的光学截面积数据应用于快速光曲线,最后在view-mode模式下,记录叶绿素荧光的初始值(F0)及最大值(Fm)、实际光量子产额(YII)及相对电子传递效率(rETR)。
1.3抗生素对莱茵衣藻伴生细菌的抑制作用
采取平板涂布结合取样镜检的方法,对经抗生素处理7 d后的藻液中存在的细菌数目进行检验。实验中,将处理组和对照组藻液用TAP液体培养基稀释100倍后,涂布在LB固体培养基平板上,37℃培养温箱中过夜培养24 h以上,直至长出菌落为止,根据单菌落的数目确定藻液中细菌的密度。
1.4数据统计分析
各实验组和对照组均设置3个平行处理,取平均值(Mean±SD)。以T检验比较对照组与实验组之间的差异显著性,P<0.05表示差异显著,P<0.01表示差异极显著。
相关新闻推荐
2、不同耐药性致病副溶血性弧菌在20℃、25℃、37℃下的生长曲线(一)
3、贯叶连翘提取物通过诱导凋亡样死亡抑制藤黄微球菌生长(三)
