摘要
评估了脉冲光和热处理对枯草芽孢杆菌孢子的联合灭活效果。分别应用这些过程,并修改两次治疗之间的时间,以评估第一次治疗的效果是否能保持很长时间。B、经过亚致死预处理的枯草芽孢比未经处理的芽孢对后续处理(PL或热处理)更敏感。在减少枯草芽孢杆菌数量方面,加热后的PL是最有效的组合。无论温度是(4°C还是30°C),细菌孢子在水中储存至少24小时后仍对后续处理敏感。枯草芽孢杆菌细胞在营养肉汤中萌发后对PL或热处理的敏感性增加,在3到24小时内同样敏感。营养细胞在孢子萌发后对后续处理保持增强的敏感性。这项工作的结果表明,加热和光致发光处理相结合是一种很有前途的微生物灭活保存方法。
1、引言
芽孢杆菌属的孢子形成细菌在环境中广泛存在,可以从用于食品生产的各种食品和配料中分离出来(Carlin,2011;Kramer和Gilbert,1989)。这些微生物形态对许多胁迫具有极强的抵抗力,包括有毒化学品和生物杀灭剂、干燥、高压、热处理、紫外线处理或电离辐射(Nicholson等人,2000年;Setlow,2006年)。虽然休眠孢子本身并不构成危害,但芽孢杆菌和其他密切相关物种的生长生物体与食物腐败甚至严重的食源性疾病有关(Setlow,2006)。热杀菌是一种有效的灭活细菌孢子的过程,但在食品中使用高温可能会导致其营养、感官或技术特性发生重大变化。因此,人们大力开发非热技术,以防止不利的热效应,生产安全的食品。
脉冲光(PL)技术是传统热去污和化学去污工艺的替代品,可在不影响产品质量的情况下提高食品安全性。该技术包括连续重复宽带发射光(190–1000 nm)的短时高功率闪烁,约40%的发射光对应于UV区域(Wekhof,2000)。
PL已成功测试了不同微生物的失活,包括营养细胞(Artíguez和Martínez de Marañón,2015b;Gómez-López等人,2005)和孢子(Artíguez和Martínez de Marañn,2015ab;Dunn等人,1989;Levy等人,2012)。然而,其在液体食品处理中的应用受到其成分、不透明度或浊度的限制,这决定了微生物暴露在入射光下(Artíguez等人,2012;Hsu和Moraru,2011),因此也决定了处理效果。通过与其他新兴技术或更温和的传统保存方法相结合,可以提高PL对复杂食品基质中微生物的灭活效果。在这方面,最近进行了一些研究,以检验光致发光处理与其他技术相结合的有效性,如脉冲电场(Muñoz等人,2012;Palgan等人,2011)、热超声(Muñoz等人,2011a,b)、压力热超声(Palgan等人,2011)超声波或乳链菌肽或乳酸的亚致死浓度(Muñoz等人,2012)。类似地,如其他灭活技术所述,适度的处理温度可以提高PL处理效率(Geveke,2008;Jayaram等人,1992)。然而,光致发光处理与温和热处理相结合对微生物失活的影响,特别是对细菌孢子减少的影响尚未得到解决。
因此,本研究的主要目的是评估连续应用光照和热处理对枯草芽孢杆菌孢子失活的影响。为此目的,确定了亚致死光致发光预处理对孢子耐热性的影响,以及在先前加热或光致发光处理后对光致发光处理的后续敏感性,以及它们在不同条件下储存期间的持久性。B、枯草杆菌被用作挑战微生物,因为它已被广泛研究作为其他孢子形成物的替代物,并且对各种物理和化学处理具有高度抗性(Nicholson等人,2000)。
2、材料和方法
2.1.菌株和孢子产生
B、枯草杆菌DSM 10(德国微生物和细胞培养物收藏,德国布伦瑞克)在-80°C的胰蛋白酶大豆肉汤(TSB,Pronadisa,Madrid,Spain)中保存,并添加20%(w/w)甘油溶液。将解冻的储备培养物(100μL)转移到10 mL TSB中,并在30°C下预培养24小时。然后将细菌菌株以103 CFU/mL接种,并在30°C下培养24小时,直到早期稳定生长阶段(107 CFU/mL)。将500μL的小份细菌培养物摊铺在营养琼脂(NA,Pronadisa,Madrid,Spain)上,并添加1 mg/L MnSO4和0.5 g/L CaCl2(Prentice等人,1972),然后在30°C下培养5-7天,直到90%的细胞形成孢子。通过使用相差显微镜观察不可折射孢子,并通过比较加热(70°C,10分钟)和未加热孢子悬浮液的计数来验证孢子形成。用无菌蒸馏水从琼脂平板上收集孢子。收集的孢子在4°C下以4000×g离心15分钟,并用无菌蒸馏水洗涤三次。实验是用独立制备的孢子悬浮液进行的。
2.2.联合治疗
实验设计示意图如图1所示。进行实验以评估PL预处理(0.5或1 J/cm2)对枯草杆菌孢子对随后加热(90°C,10分钟)或PL处理(0.5 J/cm2)的耐受性的影响,以及对阈下热处理(90°C:5、10、15或20分钟)后PL处理的耐受性的影响。样品预处理后,立即对孢子悬浮液进行第二次处理,或将其悬浮在蒸馏水或TSB中,并在4或30°C下储存不同的时间间隔,然后进行进一步处理。当孢子悬浮在TSB中时,通过在4°C下以10000×g离心10分钟的方式洗涤细胞两次,并在第二次处理之前在蒸馏水中重新悬浮。将联合处理后的枯草杆菌孢子的可培养性与未经后续处理(预处理对照)的预先处理的孢子和未经预处理(处理对照)的孵化并提交第二次处理的孢子的可培养性进行比较。每个条件治疗至少重复三次。未经处理的接种样本用作对照。

图1。PL和加热联合处理以灭活枯草杆菌孢子的实验设计示意图。
2.2.1.脉冲光处理
使用了台式SBS XeMaticA-(L hL)设备(SteriBeam Systems GmbH,Kehl,Germany)。抛光不锈钢处理反应器由一个垂直移动的石英架组成,用于在两个氙灯(上部和下部)之间放置样品。发射光谱包括190至1000 nm的波长,约20%的发射光在UV-C中,8%在UV-B中,12%在UV-A区域(Wekhof,2000)。风扇冷却系统用于防止灯具和样品过热。
将等分的300μL或枯草杆菌孢子悬浮液(如上所述制备)转移到无菌紫外线透明的超硅石英反应杯(体积300μL,光学长度1 mm,德国缪尔海姆Hellma)中,并立即在室温(23–25°C)下进行光致发光处理。将样品放置在距离上氙灯6 cm处的石英架中心,并在2.2 kV下处理。光致发光处理仅使用上部氙灯。
使用能量计(型号QE25-LP-H-MB,加拿大魁北克Gentec)和Solo2读出装置测量每个脉冲的注量,单位为焦耳/平方厘米(J/cm2)(Artíguez等人,2012)。允许测量之间至少暂停30秒,以防止探测器可能过热。所有注量测量均一式三份。
总通量(H)或单位面积照射在样品上的光子量是影响光致发光灭活微生物的最相关过程因素(Artíguez和Martínez de Marañón,2014;Lasagabaster和Martínez de Marañón,2013)。因此,总注量是通过将脉冲注量乘以发射光脉冲数(n)(H HEH0 x n)来计算的。样品暴露在0.14-12J/cm2的注量范围内。每个条件治疗至少重复三次。未经处理的接种样本用作对照。
2.2.2.热处理
热处理在带有硅胶隔膜的螺旋盖玻璃管中进行(Sigma,Aldrich,西班牙马德里)。将含有2.7 mL蒸馏水的试管浸入油恒温槽(PolyStat 37,Fisher Scientific,Leicestershire,UK)中,并预热至90°C。将k型热电偶(T1光纤温度探头,加拿大Neoptix)插入未接种的试管中,并用于控制温度。将试管平衡至适当温度后,使用1 mL注射器将等分的300μL枯草杆菌孢子悬浮液注射到试管中(Hamilton,Bonaduz,Switzerland)。在预定的暴露时间间隔(5、10、15或20分钟)后,将加热管从恒温槽中取出,并立即放置在冰槽中。在幸存者计数之前,试管一直保存在冰中。
2.3.孢子萌发和营养生长试验
通过使用Bioscreen C分析仪系统(英国贝辛斯托克Labsystems)在600 nm(OD600)处测量光密度来监测孢子萌发和随后的营养生长过程。将含有300μl TSB的每个微孔板接种30μl孢子悬浮液,初始OD600为1.0。微孔板在30°C下孵化,每5分钟监测一次每个微孔板孔的OD600。在4°C下未测定孢子萌发,因为该温度超出了本工作中使用的设备的工作范围。为了防止孢子沉降,在每次测量之前将微孔板摇晃10秒。在每次分析中,分别进行三个重复孔。实验至少重复了三次。发芽程度表示为初始OD600的分数(t时的OD600/初始OD600)。枯草芽孢杆菌孢子的萌发通过相位对比显微镜直接观察得到证实。
2.4.微生物分析
每次处理后立即测定接种的未处理(对照)和处理样品中的枯草杆菌孢子数。液体样品在1%缓冲蛋白胨水中连续稀释(西班牙马德里Pronadisa),并将0.1 mL适当稀释液表面镀在胰蛋白酶大豆琼脂(西班牙马德里Pronadisa TSA)上。将皮氏培养皿在30°C下培养72小时后,计数枯草杆菌菌落,结果以对数CFU/mL表示。将平板在30°C下再放置7天,以验证不再出现CFU。
方差分析和Tukey的诚实显着差异检验用于确定治疗之间的显着差异(pb 0.05)(SPSS Inc.,IL,美国)。
结果和讨论
3.1.PL处理后热处理对枯草杆菌孢子灭活的影响
评估了PL随后进行亚致死热处理对枯草杆菌孢子失活的影响。单独暴露于90°C下的热处理10分钟或总通量为0.5或1 J/cm2时,枯草杆菌孢子数分别减少0.6、1.1和2.7 Log(图2)。然而,当枯草杆菌孢子经过PL(0.5和1 J/cm2)和加热(90°C,10分钟)后,对数减少了2.4和4.6。光致发光预处理强度越高,对热处理的敏感性越高。ANOVA测试表明,在经过加热的PL处理后的孢子失活与单独处理的失活效果总和之间存在显着差异(数据未显示),显示出协同效应。
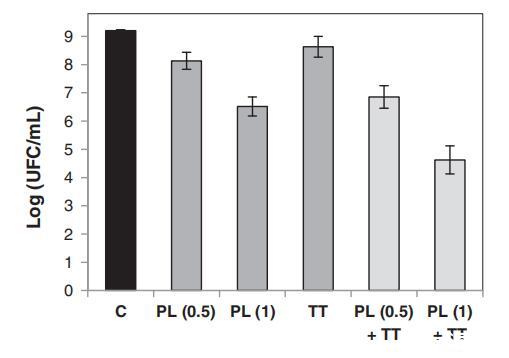
图2。未经处理的枯草杆菌孢子的存活率(C),在0.5 J/cm2的PL处理(PL(0.5))、1 J/cm2的PL处理(PL(1))、热处理(TT)(90°C,10分钟)、0.5 J/cm2的PL处理后,再进行TT(PL(0.5)+TT)或1 J/cm2的PL处理后,再进行TT(PL(1)+TT。误差线表示95%水平的置信区间。
上述结果表明,根据先前报告的结果(Artíguez和Martínez de Marañón,2015a),PL预处理将使细菌孢子对随后的热失活敏感。
有几个原因可以归因于PL预处理后对热处理的敏感性增加。如前所示,在PL处理后存活的细胞可能具有亚致死损伤(Rajkovic等人,2009;Wuytack等人,2003),这将使它们对随后的最小热处理更敏感。PL技术的抗菌作用主要归因于DNA损伤(Takeshita等人,2003)和其他结构修饰,如枯草杆菌孢子的变形或解体(Wekhof等人,2001)。PL处理和热处理对不同细胞功能的互补作用可能是亚致死PL处理后枯草杆菌孢子热敏感性增强的原因。另一方面,随后的热处理也可以抑制或降低修复先前PL处理引起的损伤的能力(例如,DNA修复机制),从而提高该序列处理的抗菌效果。
3.2.枯草芽孢杆菌孢子在30°C或4°C储存期间经过亚致死PL预处理后的热敏感性
亚致死处理后存活的孢子对应激的敏感性可以通过评估其萌发和随后的营养生长来检查(Fernández等人,2001年;Melt等人,2008年)。在600 nm(OD600)处测量孢子悬浮液的光密度可以监测萌发和随后的生长过程(Smelt等人,2008年)。如图3所示,在促进孢子萌发和生长的营养培养基(TSB)中培养表明,低强度光照处理(0.5 J/cm2)对孢子萌发没有影响,因为光照预处理孢子的OD600减少与未处理孢子没有差异。虽然暴露于0.5 J/cm2后发芽率没有受到影响,但与未处理的孢子相比,枯草杆菌的营养生长(OD600增加)延迟了约1小时(图3)。B、枯草杆菌孢子在没有营养物质的水中悬浮24小时后没有萌发,未经处理和PL处理的样品之间没有差异。
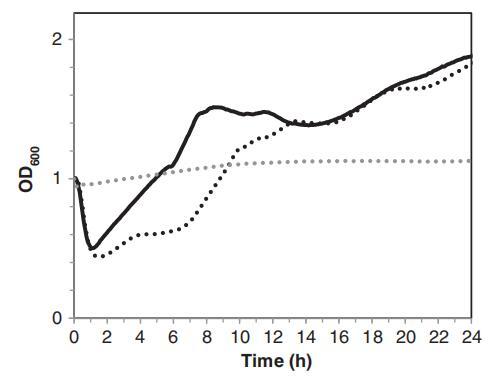
图3。枯草芽孢杆菌孢子萌发和营养生长的比较:TSB中未经处理的孢子(对照)(▬),在水中暴露于0.5 J/cm2的PL预处理的孢子,随后在TSB中孵化(…)以及未经处理的孢子或在水中暴露于0.5 J/cm2的PL预处理并随后在水中孵化的孢子(…)。在30°C下,通过OD600的变化测量发芽和营养生长。
相关新闻推荐
2、不同温度、NaCl浓度、PH、装液量对假单胞杆菌BS1生长的影响——材料与方法
