1材料与方法
1.1材料
1.1.1供试菌株从东南景天根系中分离的2株锌抗性细菌Ⅱ2R3和Ⅳ8R3:菌株Ⅱ2R3为醋酸钙不动杆菌Acinetobacter calcoaceticus,能分泌吲哚乙酸和溶解磷酸钙,Zn最小致死浓度为10 mmol·L-1;菌株Ⅳ8R3为短小芽胞杆菌Bacillus pumilus,能分泌吲哚乙酸和高铁载体,Zn最小致死浓度为20 mmol·L-1.
1.1.2供试植物华南农业大学筛选的重金属低积累玉米品种“凌单四号”
1.1.3供试土壤模拟锌污染土壤,即向华南农业大学农场的水稻土(风干,过5 mm筛)中添加ZnSO4·7H2O[w(Zn)分别为0、200、400和800 mg·kg-1)],与土壤充分混匀,于玻璃温室中培育2个月,每隔5 d翻动1次,定期加去离子水,使土壤水分保持最大田间持水量的60%左右.水稻土的理化性质如下:pH(土水质量比1.0∶2.5)6.27、w(有机质)3.05%、全氮1.12 g·kg-1、碱解氮96.8 mg·kg-1、全磷1.192 g·kg-1、有效磷86.09 mg·kg-1、有效钾126.29 mg·kg-1,总Zn 63.16 mg·kg-1.
1.2试验方法
1.2.1菌株对锌的吸收作用将甘油管保存的菌株Ⅳ8R3和Ⅱ2R3划线接种到LB固体培养基培养24 h,挑选单个菌落,接种到50 mL的LB液体培养基中,于摇床160 r·min-1、30℃培养24 h.在200 mL的LB液体培养基中加入膜过滤灭菌的Zn母液(1 mol·L-1),使Zn2+浓度分别为0、2.5、5.0、10.0 mmol·L-1.每瓶接种2 mL的新鲜菌液,置摇床160 r·min-1、30℃振荡培育,以未接种的LB液体培养基为对照,重复3次.培养6、12、20、32、56、80、104、128、152、176 h后,分别用无菌枪头取3 mL培养液,比色法测定D600nm;同时取5 mL培养液置于50 mL的离心管中,8 000 r·min-1离心,上清液转移到干净的塑料瓶,滴加1滴优级的纯硝酸,置于低温冰箱中保存,原子吸收光谱(Z-2300)测定Zn浓度.
1.2.2土培试验采用双因素完全随机区组试验设计:A因素为接种处理,共4个水平,即不接种的对照(CK)、接种菌株Ⅱ2R3、接种菌株Ⅳ8R3、同时接种菌株Ⅱ2R3和Ⅳ8R3;B因素为土壤Zn污染水平,共4个水平,即土壤Zn添加浓度分别为0、200、400、800 mg·kg-1.每个处理重复4次,每盆土壤质量4 kg(以干土计).
盆栽试验于2009年10月15日播种,挑选籽粒饱满的玉米种子进行表面消毒(自来水冲洗→φ为99%乙醇溶液1 min→φ为35%双氧水和3%次氯酸钠的混合溶液30 min→无菌水冲洗3次)后,每盆播种5粒玉米种子,15 d后间苗,每盆保留2株幼苗.同时,进行接种促生菌处理,每盆接种50 mL的107cfu·mL-1菌体悬浮物,以无菌水作为对照.促生菌在LB液体培养基上培养至对数生长期,离心收集菌体,8.9 g·L-1的NaCl溶液清洗3遍,用无菌的双蒸水把菌体稀释成约107cfu·mL-1菌体悬浮物,平板计数法确定菌体的浓度.植物生长期间定期向花盆托盘加单蒸水,以保持盆中土壤湿度.
播种90 d后,收获植物样品(地上部和根系)和土壤样品.植物样品先用自来水冲洗干净,再用去离子水冲洗3次,自然晾干.晾干的植物样品先在105℃杀青30 min,然后65℃下烘干至恒质量,称地上部和根系的干质量.土壤样品自然风干,过20目筛.
1.3测定方法
植物地上部和根系Zn含量测定采用干灰化-原子吸收光谱法,即植物样品用粉碎机磨碎后,称取0.300 0 g植物样品于50 mL的干锅,电炉上进行碳化,于马福炉中(500±5)℃灰化约8 h后,取出坩锅,冷却后加6 mol·L-1HCl溶液溶解,定容到50 mL,火焰原子吸收分光光度计(Z-2300)测定Zn含量。土壤pH测定采用玻璃电极法(水土质量比为2.5∶1.0).土壤有效Zn含量采用0.01 mol·L-1CaCl2提取,土水质量比为1.0∶2.5,90℃水浴振荡2 h,过滤,火焰原子吸收分光光度计(Z-2300)测定滤液中的Zn浓度.
1.4数据处理
采用Excel2003软件整理数据,利用SAS 9.0软件对试验数据进行方差分析,多重比较采用新复极差法(Duncan's法).
2结果与分析
2.1菌株在锌胁迫下的生长和对锌的吸收作用
随着菌株Ⅳ8R3和Ⅱ2R3的生长繁殖,培养液中Zn的剩余浓度均逐渐降低(图1).当菌株Ⅳ8R3培养176 h后,含有2.5、5、10 mmol·L-1Zn的培养液中的Zn浓度分别降低了76.94%、73.17%和53.84%;菌株Ⅱ2R3培养176 h后,培养基中的Zn浓度分别降低了40.90%、49.05%和36.49%(图1),这表明菌株Ⅳ8R3和Ⅱ2R3对Zn均有较强的抗性和吸附吸收能力,尤其是菌株Ⅳ8R3.
2.2菌株对玉米生长的影响
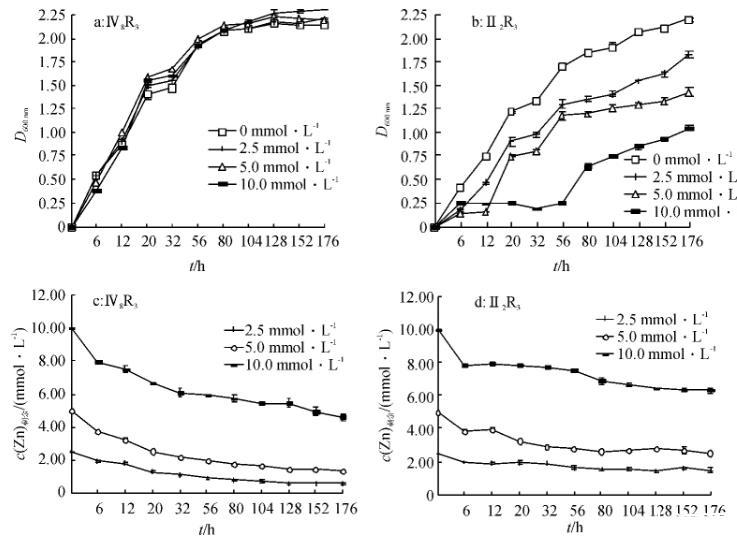
图1不同锌浓度下菌株Ⅳ8R3、Ⅱ2R3的生长曲线和培养液中锌的剩余浓度变化
菌株Ⅱ2R3和Ⅳ8R3对玉米生长的影响与土壤Zn污染水平和菌株的性质有关.在没有添加Zn的土壤中,接种菌株Ⅱ2R3使玉米地上部的干质量比对照增加了30.9%,单独或同时接种促生菌Ⅱ2R3、Ⅳ8R3使玉米的根系干质量比对照分别增加了43.8%、48.8%和19.6%;在Zn添加量为400 mg·kg-1的土壤上,接种菌株Ⅳ8R3使玉米地上部的干质量比对照增加了17.72%;在Zn添加量为800 mg·kg-1的土壤上,同时接种菌株Ⅱ2R3+Ⅳ8R3使玉米地上部和根系的干质量比对照分别增加了45.9%和55.8%(表1).
2.3菌株对玉米吸收Zn的影响
由表2可知,玉米的地上部和根系Zn含量随土壤Zn污染水平的增加而显著增加.在没有添加Zn的土壤中,不同接种菌株处理使玉米地上部和根系的Zn含量均有所增加,但与对照之间差异不显著.在Zn添加量为200 mg·kg-1的土壤上,接种菌株Ⅳ8R3使玉米根系Zn含量比对照增加了82.79%,但同时接种菌株Ⅱ2R3+Ⅳ8R3抑制了玉米对Zn的吸收和向地上部转运,地上部Zn含量比对照减少了14.34%.在Zn添加量为400 mg·kg-1的土壤上,同时接种菌株Ⅱ2R3+Ⅳ8R3后,玉米地上部的Zn含量比对照增加了3.58%,但玉米的根系Zn含量比对照减少了14.14%;单独接种菌株Ⅳ8R3反而使玉米的地上部和根系Zn含量分别比对照增加了17.97%和53.65%.在Zn添加量为800 mg·kg-1的土壤上,单独接种菌株Ⅱ2R3和同时接种菌株Ⅱ2R3+Ⅳ8R3均抑制了玉米吸收和向地上部转运Zn,地上部Zn含量分别比对照降低了4.85%和20.01%,根系Zn含量分别比对照降低了37.71%和51.73%;接种菌株Ⅳ8R3使玉米地上部的Zn含量比对照增加了9.51%,但根系Zn含量与对照之间差异不显著.

表1不同处理的玉米地上部和根系干物质量1)
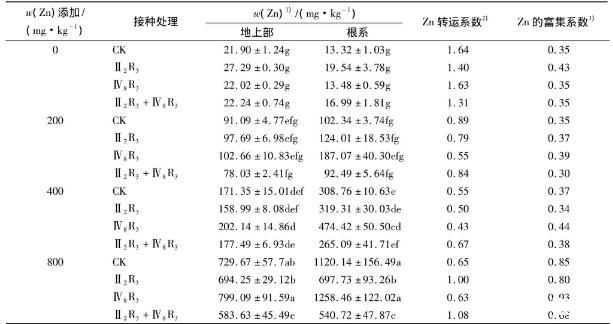
表2不同处理的玉米的地上部和根系Zn含量
2.4促生菌对土壤pH的影响
土壤pH随着土壤Zn添加量的增加而呈降低趋势.在没有添加Zn的土壤上,收获玉米后,接种促生菌的土壤pH略有降低,但与对照之间的差异不显著.在Zn添加量为200 mg·kg-1的土壤上,收获玉米后,接种菌株Ⅱ2R3或Ⅳ8R3的土壤pH分别比对照高0.23和0.07;但同时接种菌株Ⅱ2R3+Ⅳ8R3使收获后的土壤pH比对照低0.28.在Zn添加量为400 mg·kg-1的土壤上,收获玉米后,单独或同时接种菌株Ⅱ2R3和Ⅳ8R3的土壤pH分别比对照高0.28、0.37和0.24.在Zn添加量为800 mg·kg-1的土壤上,收获玉米后,3种接种处理对土壤pH影响不显著(表3).

表3不同接种处理对土壤的pH和氯化钙提取态锌含量的影响1)
2.5菌株对土壤有效态锌含量的影响
收获玉米后,土壤中的氯化钙提取态Zn含量(代表土壤Zn的有效性)见表3.从表3可见,在没有添加Zn的土壤中,单独或同时接种菌株Ⅱ2R3和Ⅳ8R3的土壤有效Zn含量比未接种的对照土壤分别降低了33.33%、33.33%和22.22%.在Zn添加量为200 mg·kg-1的土壤中,单独或同时接种菌株Ⅱ2R3和Ⅳ8R3的土壤有效Zn含量比未接种的对照土壤分别降低了52.94%、47.06%和29.41%.在Zn添加量为400 mg·kg-1的土壤中,单独或同时接种菌株Ⅱ2R3和Ⅳ8R3使土壤有效Zn含量显著降低,分别比对照土壤降低了45.88%、44.12%和59.41%.在Zn添加量为800 mg·kg-1的土壤中,收获玉米后,单独或同时接种菌株Ⅱ2R3和Ⅳ8R3的土壤有效Zn含量分别比对照土壤降低了25.28%、30.83%和42.01%.
相关新闻推荐
1、食品接触表面的微生物污染长期存在,如何筛选出代表性抗菌化合物的消毒剂
2、临床微生物实验室药敏试验三种扩散法的具体操作及试验结果(二)
3、生防菌株不同生长阶段时发酵液色素与OD650 nm的变化
