2结果与分析
2.1 Sprodbtg基因的扩增
本实验室前期构建的质粒pET28a-prodbtg中目的基因未发生突变,以该质粒作为模板,分别用引物P1、R1和P2、R1扩增基因Sprodbtg.PCR产物进行琼脂糖凝胶电泳,获得约为1,100,bp的目的片段(图1),其大小与Sprodbtg预计大小相符,表明Sprodbtg扩增成功。该基因上游外源加入了一段SD序列及C.glutamicum高效分泌蛋白的信号肽序列ΔS0949,使得prodbtg具有了在C.glutamicum中分泌表达的潜力。

2.2重组质粒pXMJ19-Sprodbtg的构建
将PCR产物切胶回收后用限制性内切酶HindⅢ和BamHⅠ进行双酶切,后与同样经过HindⅢ和BamHⅠ双酶切的质粒pXMJ19连接,然后转化至E.coli JM109,涂布含氯霉素质量浓度为50,µg/mL的平板。经筛选挑取阳性菌落活化后提取质粒,用HindⅢ和BamHⅠ双酶切验证,同时将pXMJ19空质粒用HindⅢ进行单酶切作为对照,结果如图2所示。空质粒经HindⅢ单酶切获得约6,600,bp的片段,重组质粒经HindⅢ和BamHⅠ双酶切获得约6,600,bp和1,100,bp的两条带,其中大片段与空质粒pXMJ19大小(6,600,bp)相符,小片段与目的基因Sprodbtg大小相符,表明Sprodbtg基因已成功连接到表达载体上。
2.3谷氨酸棒杆菌的电转化及鉴定
提取重组质粒pXMJ19-Sprodbtg并电击转化谷氨酸棒杆菌感受态细胞,以空质粒pXMJ19作为对照菌株。涂布于含氯霉素10,µg/mL的LA抗性平板,挑取转化子酶切验证。
2.4重组菌的诱导表达
按照1.2.4方法对转化子进行诱导表达,将诱导48,h后的重组菌株C.glutamicum ATCC13032/pXMJ19-Sprodbtg和对照菌株C.glutamicum ATCC13032/pXMJ19发酵液经TCA沉淀浓缩后进行SDS-PAGE分析,结果如图3所示。
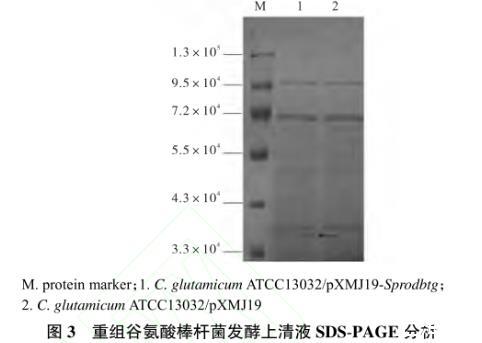
图3重组谷氨酸棒杆菌发酵上清液SDS-PAGE分析
泳道1阳性转化子C.glutamicum ATCC 13032/pXMJ19-Sprodbtg在大约3.8×104处出现1条特异性蛋白条带,其大小与预测的proD-BTG的相对分子质量一致。泳道2中对照菌C.glutamicum ATCC13032/pXMJ19未见相应目的蛋白条带,从而初步说明proD-BTG在谷氨酸棒杆菌中被成功分泌表达。
2.5酶原蛋白proD-BTG的酶活力测定
重组菌C.glutamicum ATCC13032/pXMJ19-Sprodbtg表达酶原蛋白proD-BTG经Factor Xa切割后,荧光法测定酶活力,结果显示BTG活力为(41.23±2.01)U/L。
2.6重组菌C.glutamicum ATCC13032/pXMJ19-Sprodbtg诱导条件优化
2.6.1生长曲线的绘制
重组菌在氯霉素浓度为10µg/mL的MMTG培养基中的生长曲线如图4所示。由图4可知:重组菌株4,h后进入对数生长期,14,h后生长减缓,18 h后进入稳定期。
2.6.2诱导时机对目的蛋白proD-BTG表达的影响
取不同诱导时机的发酵液添加Factor Xa并测定重组菌BTG的活力,结果如图5所示。在培养4 h后进行诱导,目的蛋白在重组菌中表达量非常低;然后随着菌体密度的增大而进行诱导,目的蛋白的表达量也随之增加。在培养12 h(A600约为2.2)时进行诱导达到最高酶活力(47.43±2.34)U/L,此时为重组菌对数生长期的中后期,目的蛋白的表达量基本达到最大,之后表达量开始下降,这可能是后期培养基中的营养被大量消耗,缺乏充足的营养用于目的蛋白的合成,因此当培养12,h后开始诱导,为最适的诱导时机。
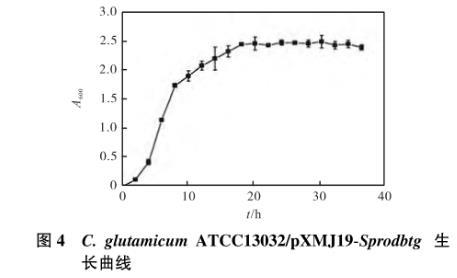
图4 C.glutamicum ATCC13032/pXMJ19-Sprodbtg生长曲线
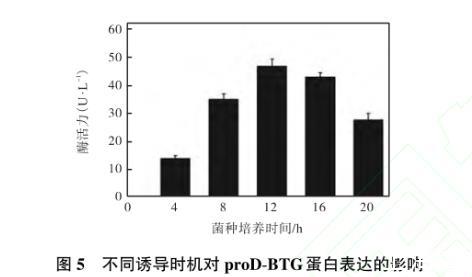
图5不同诱导时机对proD-BTG蛋白表达的影响
2.6.3诱导时间对目的蛋白proD-BTG表达的影响
如图6所示,当诱导时间为10——40 h时,目的蛋白的表达量随着诱导时间的增加而增加,最高达到(54.69±3.35)U/L;而当诱导时间超过40 h后,表达量有所下降,推测可能由于菌体开始进入衰亡期,裂解的菌体释放出的蛋白酶降解了部分重组蛋白,导致重组蛋白表达量的下降。所以最佳诱导时间定为40 h.
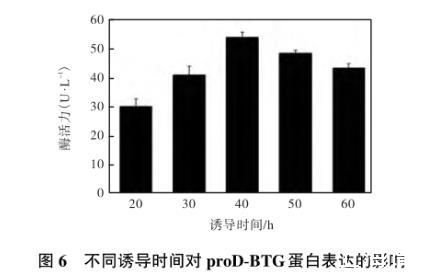
图6不同诱导时间对proD-BTG蛋白表达的影响
2.6.4 IPTG浓度对目标蛋白proD-BTG表达的影响
IPTG对细胞有一定的毒性,所以加入合适浓度的IPTG,才能使目的蛋白得到高效表达。IPTG浓度在0.01——5.0,mmol/L的范围内可能对表达产生影响。IPTG浓度对目标蛋白proD-BTG表达的影响如图7所示。
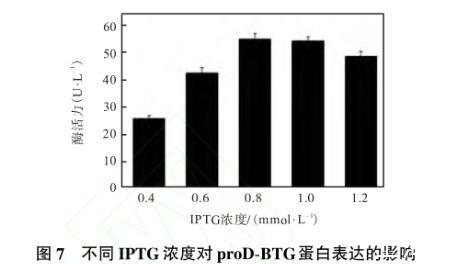
图7不同IPTG浓度对proD-BTG蛋白表达的影响
当IPTG浓度为0.4——0.8 mmol/L时,目的蛋白的表达量随着IPTG浓度的增加而增加,最高达到(55.62±2.34)U/L;当IPTG浓度增大到1.0 mmol/L时,目的蛋白的表达量也能达到最高,但考虑到成本的节约,将0.8 mmol/L作为IPTG的最优诱导浓度。
3结语
本文在前期研究的基础上,对谷氨酸棒杆菌重组菌株C.glutamicum ATCC13032/pXMJ19-Sprodbtg的发酵条件进行优化。重组菌培养12 h后A600约为2.2时,添加IPTG至终浓度为0.8 mmol/L,诱导40 h.优化后的发酵上清液酶活力由(41.23±2.01)U/L提高到(55.62±2.34)U/L,比优化前提高了约34.90%,,为BTG进一步的高效制备奠定了基础。
相关新闻推荐
1、梅花鹿体细胞航天诱变、细胞样品回收培养技术、生长曲线及核型特性(二)
