2结果
2.1重配病毒鉴定
利用反向遗传技术,构建了包含JX346基因和A/PR/8/34病毒基因的2株重配病毒,一株重配病毒的表面基因HA和NA来自JX346,内部基因来自PR8,命名为RG-H10N8;另外一株重配病毒的表面基因HA来自JX346,NA和内部基因来自PR8,命名为RG-H10N1。
两种重配病毒经序列测定显示,其HA基因与原始母本病毒比较氨基酸序列没有差异,表明HA基因是来自母本病毒的H10亚型;NA基因经序列测定显示分别是NA1和NA8亚型,内部基因来自PR8病毒,与预期相符,具体基因来源见图1。
2.2在不同培养介质上的病毒滴度测定
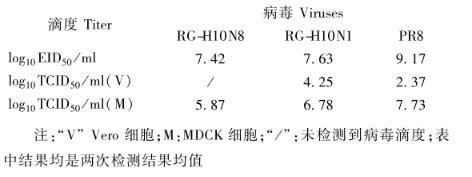
为了检测两株病毒在不同培养介质上的敏感性,将病毒分别感染Vero、MDCK和SPF鸡胚,同时以RG-PR8病毒做对照,结果显示在鸡胚和MDCK上,三株病毒均能检测到病毒滴度,在MDCK细胞上的滴度从低至高分别相差约10倍,依次是RG-H10N8
图1重配病毒基因来源示意图
注:“V”Vero细胞;M:MDCK细胞;“/”:未检测到病毒滴度;表中结果均是两次检测结果均值
2.3病毒生长曲线
上述病毒滴度测定结果显示MDCK细胞较Vero细胞对病毒更敏感,为了进一步了解病毒在MDCK细胞上的生长情况,将病毒分别以不同的MOI感染MDCK细胞,从图2中的结果可见三株病毒在不同的MOI感染后均呈现HA滴度随时间增加的趋势;在MOI=0.1和MOI=0.01感染时,在24 h时三株病毒HA滴度相差不大,虽然所有病毒感染48 h后滴度均明显上升,72 h后滴度继续上升,同时镜下观察细胞CPE较48 h明显,但是两株H10重配病毒的HA滴度在48 h和72 h时均明显低于RG-PR8病毒,重配病毒之间差异不大;在MOI=0.001时,三株病毒HA滴度均较低,病毒之间HA滴度差异不大。

图2病毒以不同MOI感染MDCK细胞的生长曲线
3讨论
近年来,禽流感病毒感染人的病例时有发生,感染人类的病毒型别也不仅限于H5N1、H7N9和H9N2亚型,2013年首次报道人感染H10N8病例后,2014年又有2例感染病例报道,因此构建H10亚型流感病毒疫苗株,并选择合适的培养介质是疫情防控的重要技术储备;WHO推荐采用传代细胞作为培养基质,利用反向遗传技术构建重配病毒作为流感大流行相关禽流感病毒储备疫苗株,即构建含有HA和NA或仅含有HA基因,其余基因来自高产的PR8的重配病毒。重配病毒可以感染细胞或鸡胚制备疫苗,但鸡胚作为疫苗生产的基质,可能引入外源性病毒污染,同时制备的疫苗产品均质性差,因此选用合适的细胞生产疫苗是流感疫苗的发展趋势,可使疫苗的抗原性更接近流行株;但不同的毒株对细胞的易感性不同,因此本研究就构建的两株H10重配病毒对MDCK和Vero细胞的易感性进行了研究,为未来研究细胞基质疫苗奠定基础。
本研究病毒感染细胞实验结果表明,在感染MDCK细胞的实验中,两株H10重配病毒均易感,在MOI=0.1和MOI=0.01感染时,病毒能达到较高的滴度但是低于PR8病毒。已有文献报道Vero细胞在流感病毒疫苗生产中的应用,但本研究结果显示在Vero细胞上RG-H10N8检测不到病毒滴度,可以检测到RG-H10N1的滴度,序列分析显示两株H10重配病毒的HA基因完全相同,仅NA基因不同,说明NA的不同会影响毒株对细胞的感染能力;但RG-H10N1检测到病毒滴度也明显低于在MDCK细胞中的培养滴度,说明Vero细胞对H10重配病毒病毒不如MDCK细胞敏感,这与之前的文献结论是一致的:即使是生长能力良好的PR8病毒在Vero细胞上也需要适应性传代以获得高滴度产物。
MDCK细胞是流感病毒分离培养的常用细胞,近年来用该细胞生产流感疫苗也获得了较好的效果,本研究的结果表明MDCK细胞较Vero细胞对流感H10亚型重配病毒更敏感,可进一步用于H10重配病毒细胞疫苗的培养基质研究。
相关新闻推荐
1、老窖泥筛选分离的6株乳酸利用菌培养、发酵性能、生长范围(一)
