近年来,鸡红细胞的免疫调节功能受到越来越多的关注。TLR已被确定为脊椎动物先天免疫识别的关键受体之一[12-13],近期研究发现,鸡红细胞可表达多种TLRs[14]。IL可以通过TLR与其配体的相互作用来诱导ILs的表达,如IL-1β、IL-6和IL-8[15]。本研究结果显示,鸡红细胞中8个免疫相关基因IL-6、IL-7、IL-12、IL-13、IL-15、IL-16、IL-18和IL-34均表达,这些基因可能通过表达水平的变化参与红细胞的免疫调节作用。
IL-6是一种多种功能细胞因子,既是一种促炎细胞因子,又是一种抗炎的肌氨酸,在鸡的免疫反应中起着重要的调节作用[16]。IL-6被证明具有很强的生物佐剂活性,可增强机体免疫功能[17]。本研究结果显示,IL-6的mRNA表达水平在体内攻毒后3 d显著下降,可能是由于病毒增殖速度快,在体内拷贝数较高,抑制了IL-6的表达,导致其在3 d表达量降低。IL-6的mRNA表达水平在感染后期(体外孵育后6、10 h和攻毒后的7 d)表达量显著上调。有报道称,IL-6能够有效改善感染流感病毒引起的肺损伤[18],据此推测IL-6的mRNA表达水平在感染后期升高,一方面改善了病毒感染对机体的损伤;另一方面增强了机体的免疫功能,对机体免疫稳态维持起调节作用。
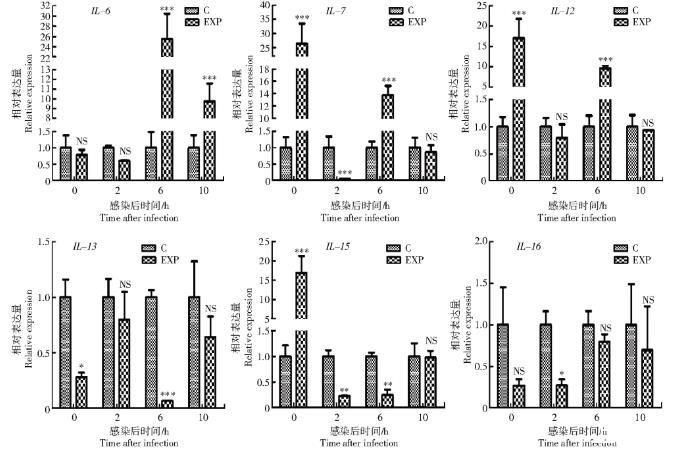
IL-7主要由淋巴组织、胸腺和骨髓的基质细胞产生,不仅在T细胞分化中起作用,也在B细胞的分化、增殖、成熟和维持过程中发挥重要作用[19-20]。IL-7是一种促炎细胞因子,其在细胞内的表达和活化可刺激炎性细胞产生大量致炎因子,致炎因子可调控炎症过程各组分之间的相互作用,维持机体免疫平衡。有研究表明,IL-7重组蛋白具有较强的免疫增强活性[21]。本研究结果显示,IL-7的表达水平在体外感染H9N2 AIV后0、6 h以及体内攻毒后的3、7 d显著上升,这与HIV感染者体内IL-7水平升高结果一致[22],推测红细胞在该时间段可能通过上调IL-7的表达量来提高B细胞和T细胞免疫功能,控制由病毒感染引起的炎症过程,但其具体的免疫机制还有待进一步证实。
IL-12是由Th1细胞及树突细胞分泌的一种促炎性细胞因子,可以调节辅助T细胞的分化,诱导NK细胞和Th1细胞分泌γ-干扰素(Interferon-γ,IFN-γ)。IFN-γ属于II型干扰素,在免疫调节和抗病毒方面发挥重要作用。鸡IL-12的结构和功能与哺乳动物IL-12相似[23],并且重组IL-12可作为生物佐剂在鸡脾细胞中诱导高水平的IFN-γ表达。本研究结果显示,随着感染的时间增加,病毒的载量和活性逐渐降低,IL-12的表达量也随之降低,这与李洁萍等[24]的试验结果一致,其结果显示,慢性乙型肝炎病毒(Hepatitis B virus,HBV)感染患者血清蛋白IL-12水平和HBV DNA载量呈现正相关。但值得注意的是,体内IL-12的mRNA表达量的变化趋势与体外表达量变化趋势相反,说明体内外免疫机制不同,具体机制还有待进一步证实。
IL-13是一种抗炎细胞因子,属于B细胞因子家族,主要在机体体液免疫反应中发挥作用,可通过参与机体免疫反应、造血和刺激急性期反应促进宿主防御机制[25],并可显著降低细胞毒性单核细胞功能和抑制单核细胞分泌促炎性递质进而控制炎症反应。李杰等[26]研究健脾益气方对人类免疫缺陷患者(Human immunodeficiency virus,HIV)体内病毒载量与IL-13相关性时,发现IL-13水平在治疗前后存在明显差异,治疗后体内病毒载量降低且IL-13水平显著升高。有文献报道,IL-13表达量的升高影响了病毒DNA合成,显著降低HIV病毒的感染性,对病毒活性有抑制作用[27]。本试验结果显示,随着攻毒时间的推移,IL-13的表达水平在检测的3个时间点(3、7、14 d)逐渐上升,与前2个研究结果完全一致。
IL-15在NK细胞发育、成熟、增殖、活化以及向炎症部位的迁移具有调节能力,对NK细胞免疫应答有重要作用,因此,能够响应感染并抑制病毒复制。哺乳动物体内的IL-15在B细胞的增殖和分化、CD4+T细胞的发育、自然杀伤细胞的增殖中都具有重要作用,在炎症反应中IL-15通过多种途径发挥促炎症作用。LIM等[28]研究表明,鸡IL-15在增强体液免疫应答过程中发挥作用。BOULASSEL等[7]研究发现,感染HIV-1患者血液中的IL-15的水平高于健康者,但在抗病毒治疗后IL-15的水平又恢复了正常。此外,一些研究者还发现,感染人类免疫缺陷病毒1亚型(Human immunodeficiency virus type 1,HIV-1)的患者患血液病毒症的概率与IL-15的水平密切相关,尤其是IL-15表达水平升高或者不稳定的患者[29]。IL-15的mRNA表达量在感染后0 h显著升高,之后表达量下降,这与前面2个的研究结果一致,说明IL-15在抵抗禽流感H9N2早期感染中发挥重要作用,IL-15也可以作为体外早期感染禽流感H9N2 AIV的一个特征因子。体内IL-15的表达量在攻毒后的7、14 d显著升高,沈桂堂等[30]研究发现,重型肝炎患者的IL-15水平在一定程度上反映了肝脏炎症严重程度,据此推测感染禽流感H9N2 AIV后引发了机体的炎症反应,但仍需进一步证实。
IL-16作为一种免疫调节细胞因子,主要发挥促炎症的作用。有研究表明,IL-16在CD4+Th1细胞的募集和激活中起重要作用,它通过刺激炎性细胞因子的分泌和促进T淋巴细胞的活化参与炎症性疾病[31]。IL-16能够促进CD4+淋巴细胞、单核巨噬细胞及嗜酸性粒细胞的应答反应。IL-16促进这些免疫细胞产生应答的主要原因是它们都能表达CD4。CD4是IL-16的主要受体,二者结合后,可以产生一系列免疫反应,比如通过抑制HIV-1的启动子抑制病毒复制。一些研究结果显示,白细胞介素IL-16的表达量在攻毒后逐渐上升,这与丙型肝炎病毒(Hepatitis virus C,HCV)患者经抗病毒治疗后IL-16表达上调相似。说明在感染初始阶段,IL-16的表达量较低,免疫功能被抑制,但是随着攻毒时间的延长,机体自身的免疫力提高,病毒载量也相应降低,以致IL-16的表达量升高。胡宽修[8]研究也发现,在感染HIV-1的患者中,治疗组的患者IL-16的表达水平高于对照组患者,且差异具有显著性。
IL-18在CD4+和CD8+T细胞反应的发展和自然杀伤细胞的诱导中发挥重要功能,同样具有促炎症作用。IL-18在机体的先天免疫和获得性免疫方面都起到重要作用[32]。袁朋等[33]在昆虫细胞中利用杆状病毒表达载体表达了鸡白介素18(cIL-18),研究发现,cIL-18蛋白可在MDCK细胞中抑制H9N2 AIV的复制。本研究结果显示,IL-18的表达量在感染后2、6 h和攻毒后7 d都显著上调,说明IL-18可能起到了免疫作用,抑制了H9N2 AIV的复制,维持了机体的免疫平衡。在研究IL-18与乙肝病毒形肝炎(Hepatitis B virus,HBV)感染的相关性时,有研究发现,HBV与IL-18表达密切相关[34],其可作为HBV诊断和疗效检测的新指标,提示IL-18也可以作为感染H9N2 AIV的一个指标。
IL-34的功能尚不完全清楚。在哺乳动物中,IL-34的功能包括促进趋化因子以及炎症细胞等的生成和释放、刺激巨噬细胞和单核细胞的增殖与分化,从而发挥促炎作用。IL-34与巨噬细胞集落刺激因子(M-CSF或CSF-1)共用一个受体CSF-1R,当配体与受体结合后可调节单核细胞和巨噬细胞的生物学功能,所以,研究集中于IL-34在一些炎症性疾病中的作用。慢性丙型肝炎病毒(HCV)感染患者肝脏纤维化阶段血清中IL-34的表达量明显升高,此外,HCV感染和炎症因子可促进体外培养的肝脏细胞表达IL-34。本研究结果显示,IL-34的表达量在体外感染H9N2 AIV的0、2、6、10 h没有发生差异变化,一定程度上说明IL-34在体外发挥的作用较小。攻毒后IL-34的表达量在7 d和14 d显著上升,推测机体感染H9N2亚型禽流感病毒后引发了强烈的炎症反应,导致机体产生了大量的炎性因子。YU等[35]也报道了同样的结果,发现在感染流感A病毒(IAV)后期,患者血清和外周血单核细胞中(PBMC)中IL-34表达量升高。IL-34的表达量在攻毒的7 d较14 d相对表达量更高,可能是由于随着感染时间的增加,机体自身的免疫力增强,而鸟类本身可能在感染后期获得一些针对特定病原体或感染的免疫力,导致14 d的攻毒水平和炎症因子水平较7 d低。
本研究结果显示,无论是鸡红细胞在培养条件下感染H9N2 AIV,还是易感雏鸡体内攻毒H9N2 AIV,鸡红细胞中IL-6、IL-7、IL-12、IL13、IL-15、IL-16、IL-18和IL-34共8种白细胞介素呈现了转录水平上的变化。表明鸡感染H9N2亚型禽流感病毒后红细胞可能发生了相应的免疫应答反应,起到抵抗病毒感染、调节机体免疫稳定的作用。
相关新闻推荐
1、菌龄、碳、氮源对产D-氨基酰化酶的菌株A55生长及酶活力的影响
