2.2重组病毒的制备、纯化和鉴定
2.2.1重组病毒的筛选
用质粒小提中量试剂盒提取高纯度转移载体质粒pT-UL2-RFP,将质粒浓缩为1μg/μL后,将该转移质粒载体与DEV共转染CEF,24 h后,即可在荧光显微镜下观察到带有红色荧光的的梭形细胞,说明质粒在该细胞中表达,待80%细胞产生病变后,收获细胞并反复冻融3次,将其接种到长有新鲜CEF单层的六孔培养板中,用含5%血清、3%NaHCO3、1%双抗、1%琼脂的M199培养液覆盖,观察荧光,挑取单个有红色荧光的蚀斑,再接种到新的细胞上,经过5轮筛选,所有的蚀斑都带有红色荧光,获得纯化的重组病毒(图2)。

图2表达红色荧光的重组DEV病毒
2.2.2重组病毒的鉴定
用鉴定引物ORFC17F/ORFC17R对重组病毒进行PCR扩增鉴定,得到大小约为2000 bp的片段(图3),与理论值相符。
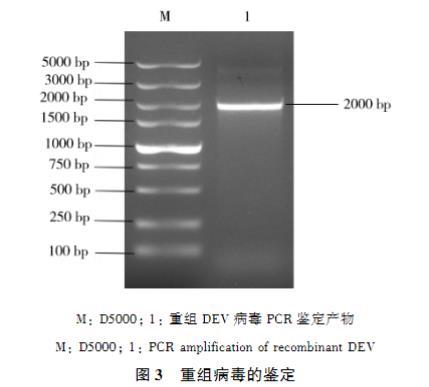
将PCR产物送北京华大基因生物公司测序,结果显示重组病毒缺失UL2基因,且带有RFP标记基团。
2.3一步生长曲线绘制
重组病毒及其亲本毒的一步生长曲线。图4结果表明,亲本毒接种CEF后48 h,病毒含量达到峰值106.5TCID50/0.1 mL,84 h上清样品病毒含量达到峰值106.75TCID50/0.1 mL。而表达红色荧光蛋白的重组病毒细胞的病毒含量在48 h达到峰值,为106.4TCID50/0.1 mL,上清样品的病毒含量在84 h达到峰值,为106.83TCID50/0.1 mL,与亲本毒无差异(P>0.05)。
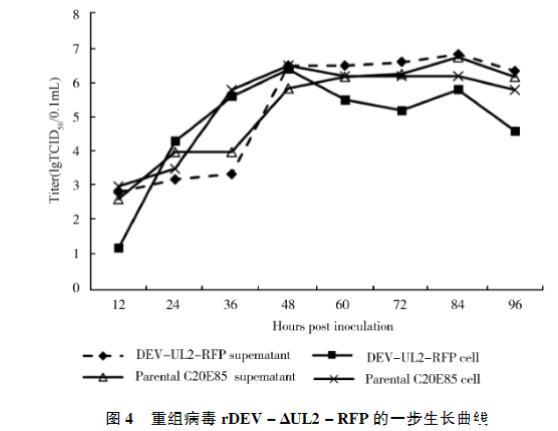
图4重组病毒rDEV-ΔUL2-RFP的一步生长曲线
2.4重组病毒的传代稳定性
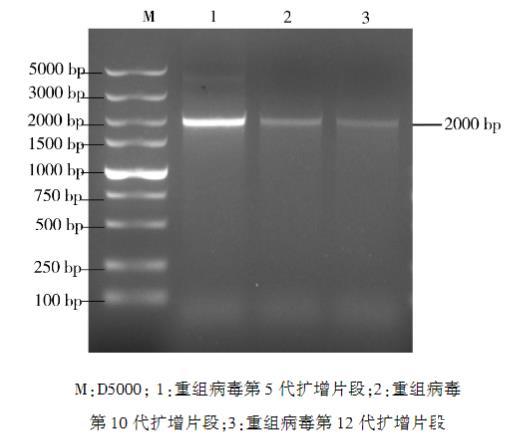
重组病毒经传代12次,荧光显微镜下观察红色荧光在1~12代均可稳定表达,所有产生CPE的细胞均带有红色荧光(图5)。重组病毒第5代、第10代、第12代PCR均扩增出2000 bp片段(图6)。测序结果表明,RFP序列未出现变异。

图5重组病毒的传代稳定性检测
3讨论与结论
本研究筛选并纯化了表达RFP的UL2基因功能缺失的重组鸭肠炎病毒,并对其生物学进行初步研究。研究表明该重组病毒的生长特性与亲本毒相似,并且可在CEF上连续稳定传代。与GFP相比,RFP在DEV中更稳定,至少在UL2基因内,RFP更适合重组DEV的反向筛选。
传统同源重组技术常以GFP、RFP、LacZ等作为重组病毒筛选标记基团,LacZ作为标记基团其缺点是分子量较大,不便于启动子克隆时重组质粒的构建,通过化学显色,检测灵敏度低,操作繁琐;荧光蛋白如GFP、RFP分子量小,发光强,操作简单,可直接在荧光显微镜下观察,易于检测,对基因功能、蛋白表达、定位示踪等诸多研究发挥了重要作用。但是目前已有研究表明,GFP在重组病毒中不稳定,随着传代次数的增加易发生点突变或缺失,Fang等构建表达GFP的北美1型猪繁殖与呼吸综合征的感染性克隆,拯救出含有GFP的病毒粒子,当病毒连续传代至第7代时,发现GFP基因发生突变;孙莹等研究显示表达GFP的重组鸭瘟病毒,绿色荧光在1~5代可以稳定表达,从第6代开始可观察到少量没有荧光的细胞病变,15~20代绝大部分细胞病变无绿色荧光,对重组DEV的筛选带来极大困难。红色荧光蛋白(RFP)出现较GFP稍晚,其可以激发和发射波长段也不同。本研究将RFP替代GFP,获得了一株表达红色荧光的重组DEV,且一步生长曲线表明RFP对DEV的生长无影响;RFP连续传代12代,能够稳定表达且无突变。试验证明RFP稳定性更强,与研究报道一致。根据本实验室在重组DEV筛选方面的经验,通常在10代以内就能够克隆纯化到重组病毒,因此本研究仅将RFP连续传代至12代,未进行更多的传代。本研究结果对重组DEV的构建、筛选具有很好的借鉴意义。
相关新闻推荐
2、源自丹麦奶酪盐水的天然汉森德巴利菌菌株生长曲线及抗真菌活性
3、沼泽红假单胞菌R1菌株的培养基配方、培养条件、生长量及影响因素(一)
