2.3健康易感猪筛选
用竞争ELISA方法和试管凝集方法同时检测30份猪血清中的猪丹毒抗体,将血清抗体PI值≤10.0%的猪判定为抗体阴性猪。结果(表2)显示,28头猪PI值均≤10.0%且试管凝集试验结果均为阴性,另外2头猪PI值分别为12.4和11.0,且试管凝集试验结果均为可疑。

表2猪血清抗体检测结果
2.4 CVCC43005株对猪最小致死剂量测定
结果(表3)显示,以3.5×1010CFU活菌静脉注射56~63日龄健康易感猪,2只试验猪在4 d内全部死亡,病死猪表现为精神沉郁、喜卧、不愿走动、厌食、颈部出现暗红色丘疹(图2)。说明CVCC43005株对猪最小致死剂量为3.5×1010CFU/头。
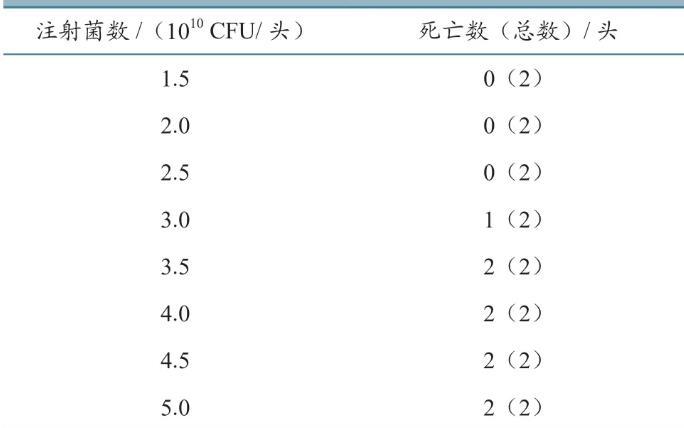
表3 CVCC43005株对猪最小致死剂量测定

图2发病猪颈部出现暗红色丘疹
2.5不同冻干代次CVCC43005株菌种毒力检定
1986、1996、2006、2015年4个冻干代次的CVCC43005株菌种按照最小致死剂量攻击猪,均可使猪全部死亡,毒力检定结果(表4)均符合要求。根据不同冻干代次CVCC43005株菌种毒力检定结果,CVCC43005株菌种毒力检定标准为取56~63日龄健康易感猪2头,经静脉注射菌液5.0 mL/头(活菌浓度不高于7.0×109CFU/mL),观察4 d,应全部死亡;取18~22 g小白鼠5只,经皮下注射菌液0.2 mL/只(活菌浓度不高于50 CFU/mL),观察7 d,应全部死亡。

表4不同冻干代次CVCC43005株菌种毒力检定结果
2.6不同冻干代次CVCC43005株菌种免疫原性检定
4个冻干代次的菌株制备成灭活抗原后,分别按灭活抗原0.1 mL及灭活抗原40%氢氧化铝胶生理盐水4倍稀释液0.2 mL免疫小鼠。结果(表5)显示,攻击1 000 MLD强毒菌液免疫组小鼠全部健活,对照组小鼠全部死亡,攻击1 MLD CVCC43006强毒菌液对照组小鼠全部死亡,攻击1 MLD CVCC43008强毒菌液对照组小鼠死亡4只。说明符合毒力检定标准的菌种,其免疫原性检定亦符合要求。

表5不同冻干代次菌株对小鼠的免疫原性单位:只
3讨论
《规程》对猪丹毒丝菌C43-5的毒力检定标准为“以肉肝胃消化汤培养24 h的菌液1~5 mL(每1 mL不少于活菌30亿),静脉注射断奶后1~3个月体质量20 kg以上的健康易感猪2头,应于4 d内死亡;5~10个活菌注射18~22 g小白鼠5只,均应于7 d内死亡”。现标准中主要存在两个问题:一是原标准中对猪的毒力标准仅规定了攻毒菌数的下限“每1 mL不少于活菌30亿”,没有规定上限,检定过程中可以不断增加攻毒菌数,直至猪死亡,相当于菌株没有毒力标准;二是原标准动物日龄过于宽泛,跨度3个月,猪的体质量有较大差别,对菌株的抵抗力也大不相同。为解决上述问题,本研究对猪丹毒丝菌C43-5株在肉肝胃消化汤中的生长规律进行了分析,缩小了检验动物日龄范围,测定了菌株对规定日龄范围猪的最小致死剂量,并对1986、1996、2006、2015年4个冻干代次的菌种进行了毒力和免疫原性测定。
通过分析猪丹毒丝菌C43-5株在肉肝胃消化汤中的生长曲线,选用培养16 h的菌液,初步探索出了更为合理的菌种毒力检定标准:选择56~63日龄健康易感猪2头,经静脉注射菌液5.0 mL/头(活菌数不高于7.0×109CFU/mL),观察4 d,应全部死亡;取18~22 g小白鼠5只,经皮下注射菌液0.2 mL/只(活菌数不高于50 CFU/mL),观察7 d,应全部死亡。同时,本研究对4个冻干代次菌种进行了毒力和免疫原性测定,发现4个代次的菌种毒力和免疫原性均符合规定。目前,猪丹毒菌种每隔10年需要进行1次制备和检定,包括复壮、冻干、真空度测定、纯粹检验、剩余水分测定、培养特性、生化特性、毒力、免疫原性等步骤,费时费力。而本研究结果显示,保存36、26、16年菌种的毒力、免疫原性均可达到菌种的检定标准,这为进一步延长菌种的保存时间提供了有力的数据支撑。
