2.2土壤细菌群落的多样性分析
Chao1、Faith_pd、Observed和Shannon指数是反映微生物群落丰富度和多样性的重要指标。6块试验田不同月土壤细菌的Chao1、Faith_pd、Observed和Shannon指数见图5,CK与EG不同月的Chao1、Faith_pd、Observed和Shannon指数见表1。根据图5中Chao1、Faith_pd、Observed和Shannon指数随时间的变化规律表明:4月CK和EG物种多样性与丰度高于其他4个月,在5月EG物种多样性与丰度最低。由表1可知,CK与EG的Chao1、Faith_pd、Observed和Shannon指数在4−8月份存在一定差异,6月CK与EG对应的4个α多样性指数差异不大,5月CK与EG对应的4个多样性指数差异最大,且EG的α多样性指数远小于CK,从而导致5月CK的物种多样性指数远高于EG。通过CK与EG在4−8月物种多样性指数变化表明稻田环沟引入蟹后可以明显改变土壤中细菌群落的物种多样性与丰度,其中4月和8月可以提高细菌群落的物种多样性与丰度,5月降低细菌群落的物种多样性,而6月对细菌群落的物种多样性与丰度的影响不明显。
2.3细菌群落结构组成
2.3.1门水平分类下土壤细菌群落结构组成
在门水平下,将试验田CK和EG在4−8月相对丰度排名前20的土壤细菌绘制柱形图(图6A)。细菌群落主要由变形菌门(Proteobacteria,96.64%−23.19%)、拟杆菌门(Bacteroidetes,19.85%−0.35%)、脱硫杆菌门(Desulfobacterota,17.48%−0.01%)、放线菌门(Actinomycetota,10.99%−0.79%)、绿屈挠菌门(Chloroflexi,10.84%−0.21%)、厚壁菌门(Firmicutes,8.75%−0.65%)、出芽单胞菌门(Gemmatimonadota,7.17%−0.81%)、酸杆菌门(Acidobacteria,5.02%−0.32%)、蓝菌门(Cyanobacteria,4.35%−0.01%)和疣微菌门(Verrucomicrobiota,3.49%−0.02%)、等构成。其中最优势菌门为变形菌门,较优势菌门为拟杆菌门和脱硫杆菌门。
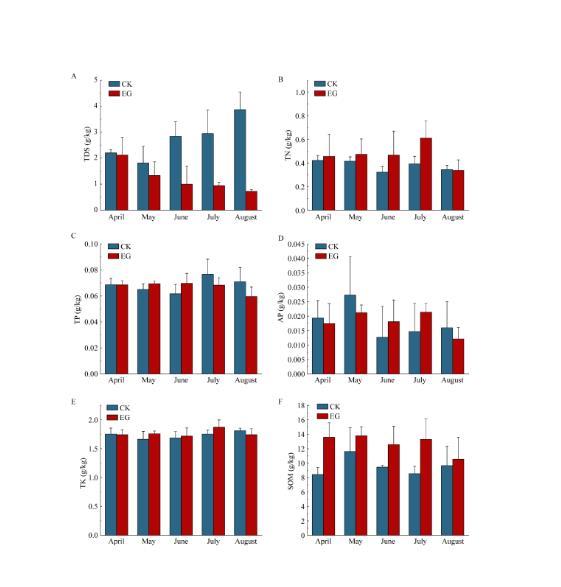
图3不同月份CK和EG组土壤6种理化指标的变化特征
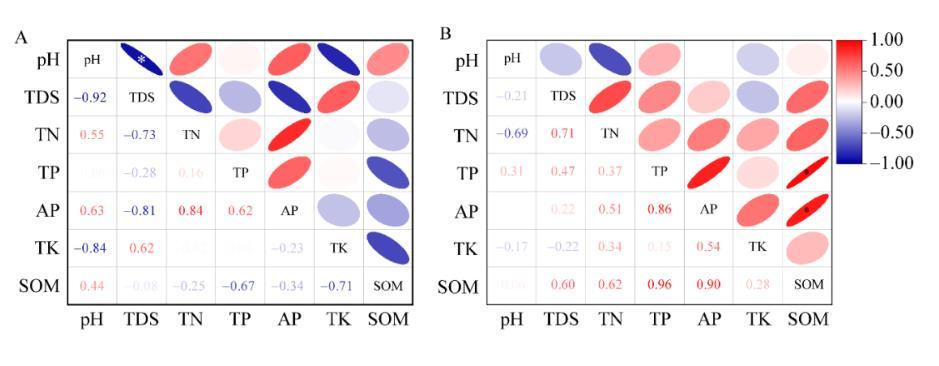
图4土壤理化因子相关性分析
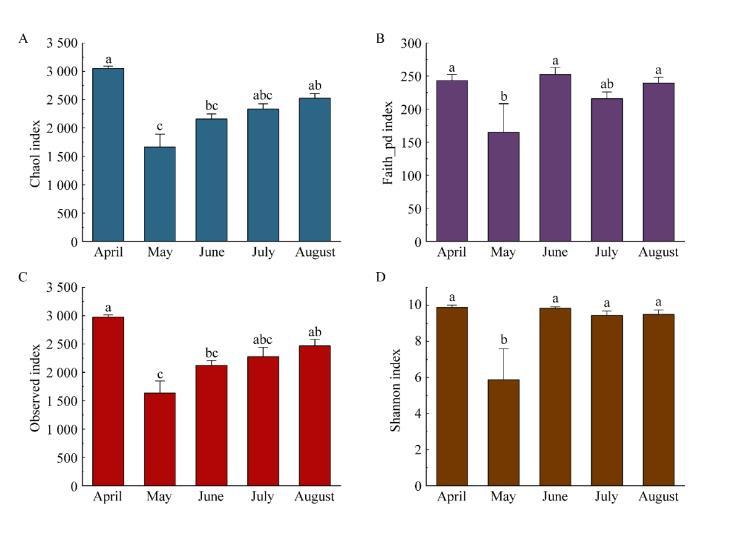
图5不同月份试验田土壤细菌群落α多样性指数
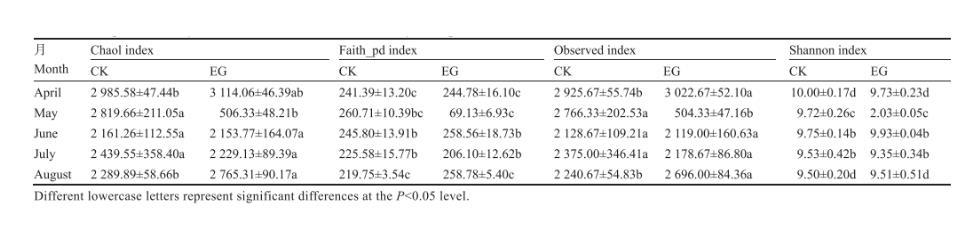
表1不同月份试验田土壤细菌群落α多样性指数
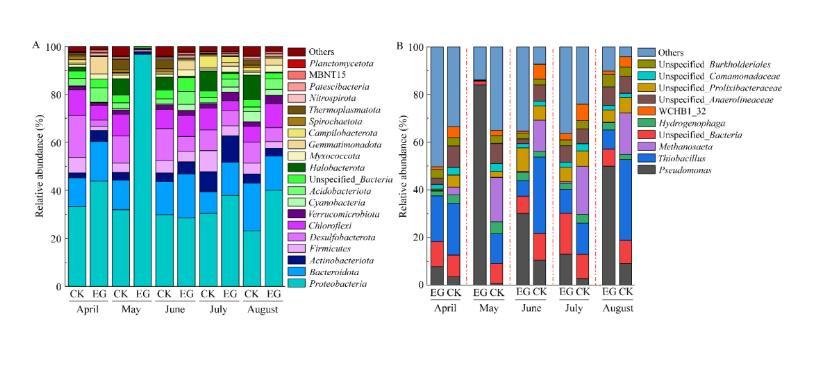
图6不同月份土壤细菌群落相对丰度
CK与EG的优势菌门具有显著的差异。CK在4−8月优势菌门为变形菌门、拟杆菌门、脱硫杆菌门和绿弯菌门,其中变形菌门相对丰度处于绝对优势,但在4−8月变形菌门的相对丰度呈现下降趋势。EG在4−8月变形菌门相对丰度处于绝对优势,在5月其相对丰度最高(96.64%),绿弯菌门在4−8月其相对丰度呈现增加趋势(除5月外)。与CK相比,引入蟹后的EG在4−8月相对丰度排名前20的细菌累积相对丰度都高于CK,说明引入蟹后能明显改变稻田土壤微生物群落结构和物种丰度。
对相对丰度前10的细菌进行相关性分析,研究表明变形菌门与其菌门呈现负相关关系,与拟杆菌门、脱硫杆菌门和厚壁菌门的相关系数分别为−0.608、−0.541和−0.602,且呈现显著性差异(P<0.05)。除变形菌门外,拟杆菌门与其他菌门呈现正相关关系,与疣微菌门、蓝细菌门和酸杆菌门的相关系数分别为0.385、0.422和0.417,都呈现显著性差异(P<0.05)。
2.3.2属水平分类下土壤细菌群落结构组成
在属水平下,将试验田EG与CK在4−8月相对丰度排名前10的土壤细菌绘制柱形图(图6B)。试验田土壤细菌群落相对丰度前10的细菌属分别为Pseudomonas(84.11%−2.69%)、Thiobacillus(33.18%−0.31%)、Methanosaeta(20.12%−0.14%)、Unspecified_Bacteria(17.18%−1.55%)、Unspecified_Prolixibacteraceae(9.87%−0.02%)、Unspecified_Anaerolineaceae(9.06%−0.07%)、WCHB1_32(7.02%−0.07%)、Hydrogenophaga(5.21%−0.25%)、Sphingomonadaceae(5.19%−0.05%)、Unspecified_ Burkholderiales(5.06%−0.05%)和Unspecified_ Comamonadaceae(3.28%−0.01%)。CK与EG土壤细菌群落结构存在一定的相关性也有各自特征。4−8月EG中Pseudomonas相对丰度始终高于CK,且EG中Pseudomonas相对丰度一直处于较高水平,特别在5−7月。CK中相对丰度较高的菌属为Thiobacillus、Unspecified_Bacteria、Methanosaeta和WCHB1_32菌属。在4−8月EG中Thiobacillus的相对丰度都低于CK。通过CK与EG属水平排名前10的菌属相对丰度对比表明,引入蟹后会提高EG土壤细菌中Pseudomonas菌属的相对丰度,同时也会降低Thiobacillus和Methanosaeta菌属的相对丰度。
2.4细菌群落结构比较
利用基于Bray-Curtis距离的NMDS方法评估不同种养模式及不同月土壤细菌群落的相似性,结果见图7。Stress<0.2表明图形具有较好的表现意义,R>0表示分组有效,P<0.05为显著性差异,椭圆是质心周围的95%置信区间。由图8可知,ANOSIM统计检验显示,CK与EG土壤细菌群落的组成存在显著差异(Stress=0.080<0.2,P-value=0.001,R=0.706),同时CK和EG土壤细菌群落与不同采样月有显著差异(Stress=0.080<0.2,P-value=0.014,R=0.176。结果表明引入蟹后对细菌群落结构组成的影响远大于采样月的影响。
2.5不同种养模式下土壤微生物群落结构与理化因子的相关性
采用冗余分析(RDA)对试验田土壤理化因子和土壤细菌门水平主要物种进行关联分析。通过计算方差膨胀因子系数VIF值,表明7个理化因子膨胀系数均小于5。在门水平上将理化因子与土壤排名前10的优势细菌群落进行RDA分析(图8A)。环境因子的长度表征对土壤细菌的影响,长度越长,相关性越高,影响越大;当环境因子与菌门的夹角为余弦值时,余弦绝对值越大,则影响程度越高,值为正表示正相关,为负表示负相关;若正交,则不相关。蒙特卡洛检验结果表明,TN是影响土壤细菌群落结构变化的关键因子。
图7土壤细菌群落结构在不同区域和不同月份的非度量多维尺度分析(NMDS)与ANOSIM分析

图8理化因子与土壤微生物群落组成(门水平)相关分析A:RDA分析.B:相关性热图.
对土壤细菌群落中相对丰度排前10的优势菌门与土壤理化因子进行Spearman相关性分析(图8B),结果表明所选7个理化因子中TDS、TN、TP、AP和SOM与相对丰度前10的菌门具有显著性差异,其中AP与放线菌门和绿屈挠菌门呈现极显著负相关关系(P<0.001),相关系数分别为−0.636和−0.746。TN主要影响变形菌门、拟杆菌门、脱硫杆菌门和疣微菌门,且与它们都呈负相关关系。pH和TK与相对丰度前10的优势菌门均无显著性差异,与细菌主要呈正相关关系,且与优势菌门的相关性系数r<0.4。
相关新闻推荐
2、解锁微生物代谢奥秘:新一代生长曲线分析平台加速乳糖/纤维二糖代谢研究(二)
