1.4运动性试验
挑取亲本株ATCC 19115、缺失株ΔmogR和ΔflaA,以及回补株cΔmogR和cΔflaA单菌落接种于BHI液体培养基中,37℃、200 r/min培养12 h,随后1:100转接至新鲜BHI液体培养基中,37℃、200 r/min下培养至OD600为1.0。取5μL菌液穿刺接种于BHI软琼脂(0.375%)平板,分别于4℃培养20 d、28℃培养48 h和37℃培养48 h,测量运动圈直径。每株菌3个重复,试验进行2次,用GraphPad Prism 8进行统计和数据可视化。
1.5透射电镜(transmission electron microscope,TEM)观察
将菌株ATCC 19115、ΔmogR、ΔflaA、cΔmogR和cΔflaA分别于4、28、37℃下培养至对数期,然后各取1 mL菌液于1.5 mL EP管中,2 000 r/min离心10 min,菌体沉淀经过1 mL 1×PBS洗涤后再用1 mL 1×PBS重悬,即制成TEM试验样品。取样品、超纯水和PTA染液各20μL滴于冷却的封口膜上,将铜网扣在样品液滴上吸附1 min,滤纸吸去多余液体后再扣于超纯水液滴上并立即用滤纸吸干,再将铜网扣于PTA染液上染色1 min,用滤纸吸干,待铜网自然干燥后即可用TEM观察菌体鞭毛生长情况。统计单位样品菌量中至少含有一根鞭毛的菌株的百分比,用GraphPad Prism 8进行数据可视化。
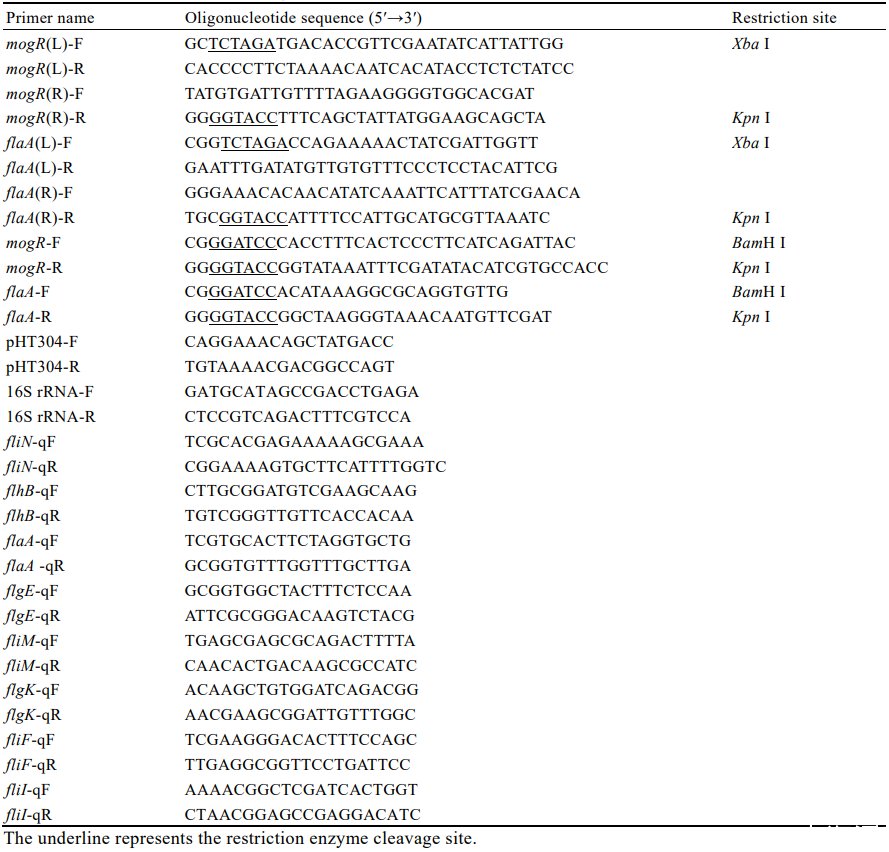
表2本研究所用引物
1.6 RT-qPCR
提取分别在4、28、37℃条件下培养至对数期的ATCC 19115、ΔmogR、ΔflaA、cΔmogR和cΔflaA菌体RNA,用反转录试剂盒进行逆转录,获得的产物cDNA即为RT-qPCR的模板。按照2×T5 Fast qPCR Mix(SYBR Green I)试剂说明书对鞭毛合成基因flaA、fliN、flhB、flgE、fliM、flgK、fliF和fliI及16S rRNA基因(作为内参基因)进行RT-qPCR。用2−∆∆Ct相对定量法对结果进行表达差异性分析。
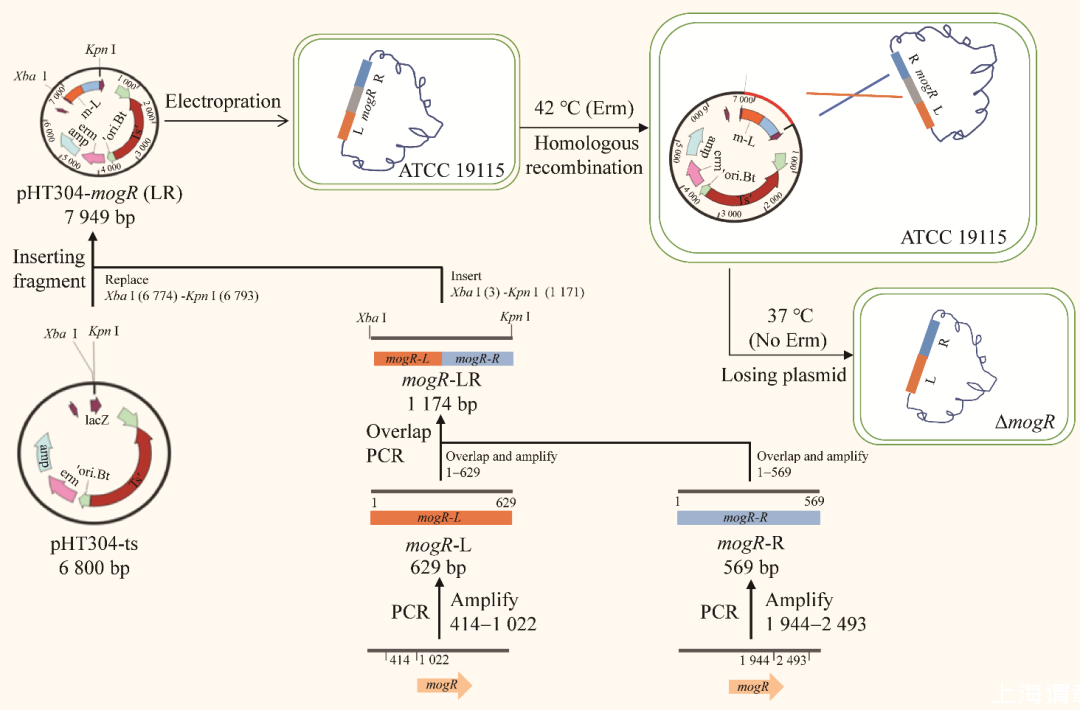
图2缺失株ΔmogR构建流程图
1.7生长曲线测定
挑取ATCC 19115、ΔmogR、cΔmogR、ΔflaA和cΔflaA单菌落接种于BHI液体培养基,37℃、200 r/min培养12 h,然后按1:100接种量转接至新鲜BHI液体培养基中,37℃、200 r/min培养至OD600为1.0后按1:100接种量转接于BHI液体培养基中,然后分别进行生长曲线测定。(1)4℃生长曲线测定:置菌液于4℃冰箱中静置培养,每隔1 d测定OD600值;(2)28℃生长曲线测定:把菌液转接至96孔蜂窝板,将蜂窝板置于全自动生长曲线分析仪,设置培养温度和时间,每隔1 h测定OD600值;(3)37℃生长曲线测定同28℃的测定。用GraphPad Prism 8绘制生长曲线。
2结果与分析
2.1低温下MogR对Lm运动能力的影响(swarming)
在4℃和37℃培养条件下,缺失株ΔmogR的运动圈明显大于亲本株(图3、图4),且随着时间的延长,ΔmogR与亲本株的运动性存在显著性差异(P<0.01)(图4)。cΔmogR、ΔflaA和cΔflaA在4℃和37℃条件下均与亲本株一样无明显运动圈(图3、图4)。在28℃条件下,仅ΔflaA无运动性,其他菌株均有明显运动圈(图3、图4)。结果表明,MogR在4℃时对鞭毛基因表达有抑制作用,从而降低了Lm的运动性。
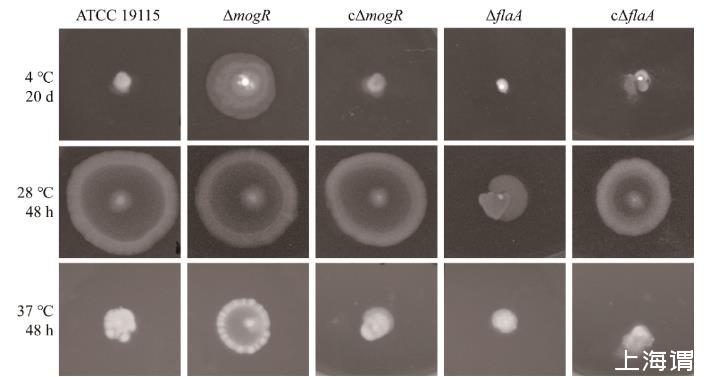
图3菌株ATCC 19115、ΔmogR、cΔmogR、ΔflaA和cΔflaA分别在4、28、37℃下的运动能力
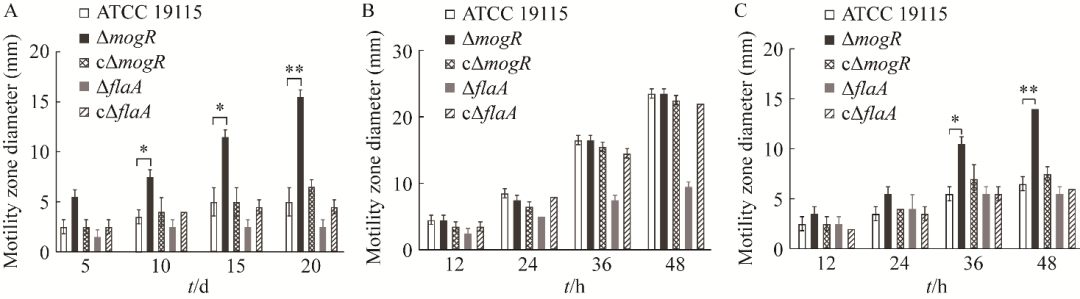
图4菌株ATCC 19115、ΔmogR、cΔmogR、ΔflaA和cΔflaA分别在4℃(A)、28℃(B)和37℃(C)下的运动圈直径大小
2.2低温下MogR对Lm鞭毛合成的影响(TEM)
TEM结果显示,在4℃条件下,缺失株ΔmogR含鞭毛菌株比例高于亲本株ATCC 19115(图5)。统计分析结果表明,在4℃和37℃条件下,ΔmogR鞭毛数量均显著高于亲本株(P<0.001),回补株cΔmogR鞭毛量与亲本株无显著性差异(图6A、6C);在28℃条件下,ΔmogR和cΔmogR鞭毛数量与亲本株无显著性差异(图6B)。在4、28、37℃三个温度条件下,缺失株ΔflaA均未产生鞭毛,回补株cΔflaA鞭毛量均与亲本株无显著差异(图5、图6)。亲本株在4℃时有少量鞭毛产生,但其数量显著低于28℃时的数量(P<0.001)(图6D)。ΔmogR鞭毛量在3个温度下无显著性差异(图6D)。TEM结果表明,在4℃条件下,MogR对Lm鞭毛的产生有抑制作用。

图5透射电镜(TEM)下观察到的菌株ATCC 19115、ΔmogR、cΔmogR、ΔflaA和cΔflaA分别在4、28、37℃时的鞭毛生长情况显示在图像下方的数值是单位样品菌量中至少含有一根鞭毛的菌株的百分比
2.3低温下MogR对Lm鞭毛基因表达的影响(RT-qPCR)
首先测定了4、28、37℃条件下ATCC 19115、ΔmogR、ΔflaA、cΔmogR和cΔflaA的鞭毛丝蛋白基因flaA的转录表达水平(图7)。在4℃时,与亲本株ATCC 19115相比,缺失株ΔmogR的flaA表达量极其显著上调(P<0.001),回补株cΔmogR的flaA表达量则无显著性差异(图7A);缺失株ΔflaA的flaA表达量为0,其回补株cΔflaA有flaA表达(图7A),表明缺失株和回补株构建成功。温度之间的比较结果显示:缺失株ΔmogR在4℃和37℃时的flaA表达量与28℃时的相比无显著性差异(图7B),即mogR缺失后,菌株在不同温度下的flaA表达量不存在差异性;亲本株ATCC 19115和回补株cΔmogR在4℃和37℃时flaA表达量均显著低于28℃时的表达量(亲本株的4℃与28℃相比P<0.01,其余均为P<0.001)(图7B)。结果表明,在低温4℃时,MogR抑制了Lm鞭毛丝蛋白基因flaA的转录表达。
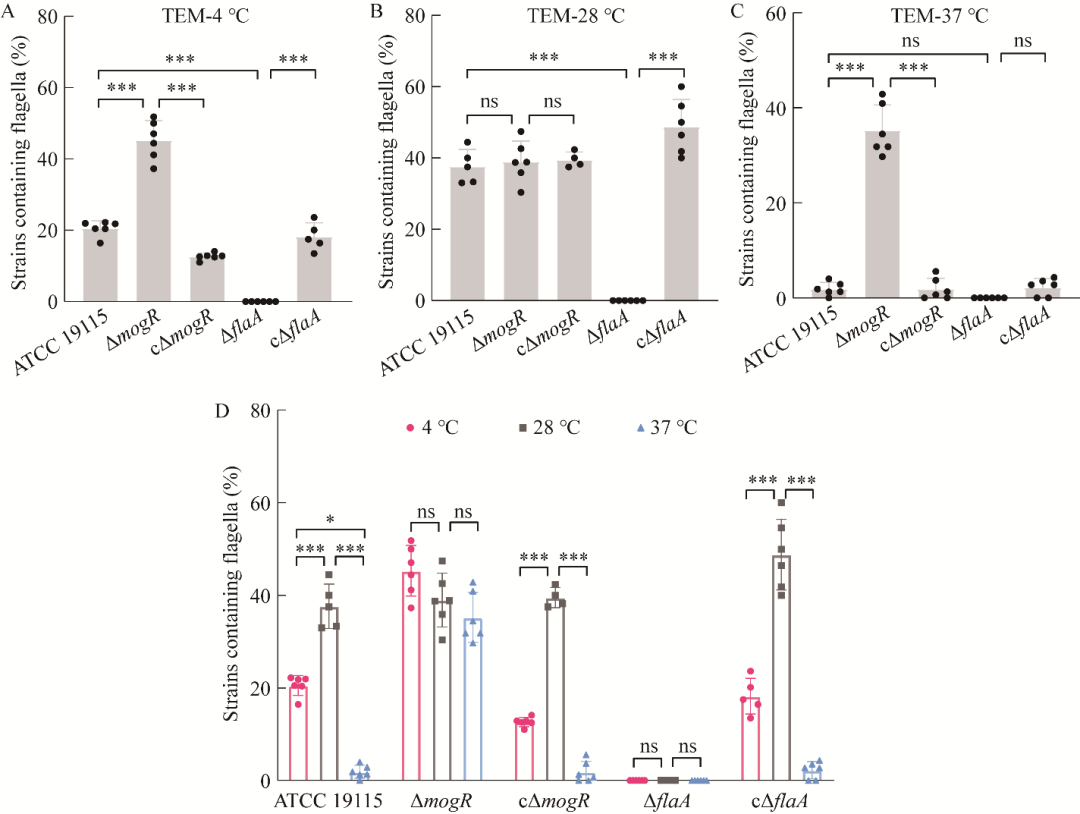
图6通过TEM观察的菌株ATCC 19115、ΔmogR、cΔmogR、ΔflaA和cΔflaA分别在4℃(A)、28℃(B)和37℃(C)时的单位样品菌量中至少含有一根鞭毛的菌株的百分比柱状图及同一菌株在不同温度下的菌株的百分比柱状图(D)
除flaA外,本研究根据Lm鞭毛蛋白的功能及其基因在操纵元上的分布(图1),还选择fliN、flhB、flgE、fliM、flgK、fliF和fliI这7个鞭毛基因(表3)进行了在4、28、37℃条件下在缺失株ΔmogR、回补株cΔmogR和亲本株ATCC 19115中的转录表达水平的测定。结果显示,4℃时,ΔmogR的7个鞭毛基因表达量显著高于亲本株(P<0.01或P<0.001),cΔmogR的与亲本株的无显著性差异(图8A);28℃时,ΔmogR和cΔmogR的7个鞭毛基因表达量与亲本株的均无显著性差异(图8B);37℃与4℃的情况相似(图8C)。结果表明,4℃时MogR对鞭毛操纵元上的基因表达均有抑制作用。
RT-qPCR结果与运动性结果和TEM结果相对应,表明MogR低温4℃时,同在37℃时一样,抑制了鞭毛基因的表达。
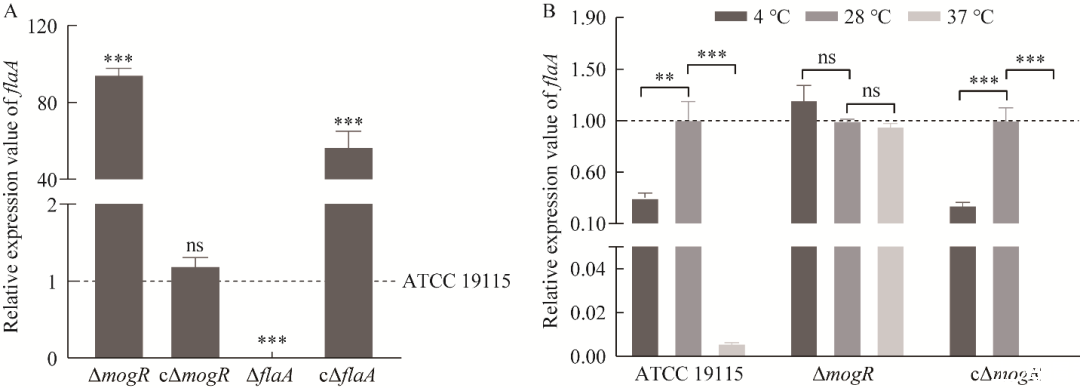
图7鞭毛丝蛋白基因flaA的转录表达水平A:4℃条件下与亲本株ATCC 19115相比,ΔmogR、cΔmogR、ΔflaA和cΔflaA的flaA的相对表达量.B:与28℃相比,4℃和37℃条件下ATCC 19115、ΔmogR和cΔmogR的flaA的相对表达量
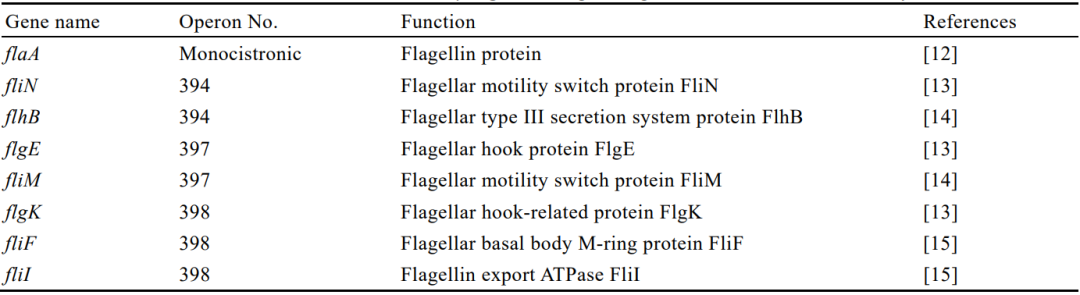
表3本研究选择的8个单增李斯特菌鞭毛基因的信息
相关新闻推荐
2、植酸酶基因修饰的土著细菌实现水解黑土植酸并提高有效磷含量——结果与讨论、结论
