目录
一、无菌室的要求
二、样品准备
三、培养基与试剂制备的制备和杀菌
四、微生物实验操作
五、微生物实验室废弃物处理
六、实验结果报告
七、实验室设备的校准、维护和性能验证
一.微生物无菌室基本要求及管理
1.1无菌室的基本建设要求
1.1.1根据本实验室所涉及的生物安全等级,无菌室的设计和建设应符合GB 50364和GB 19489的相关要求。
1.1.2无菌室大小应能够满足检验工作的需要,内墙为浅色,地面和地面应光滑,墙壁与地面、天花板连接处应呈凹弧形,无缝隙,无死角,易于清洁和消毒。
1.1.3无菌室入口处应设置缓冲间,缓冲间内应安装非手动式开关的洗手盆,并可有毛巾。缓冲间应有足够的面积以保证操作人员更换工作服及鞋帽。
1.1.4无菌室内工作台的高度约80cm,工作台应保持水平,工作台二应无渗漏,耐腐蚀,易于清洁、消毒。
1.1.5无菌室内光照应分布均匀,工作台面的光照度应不低于540Ix。
1.1.6无菌室应具备适当的通风和温度调节的条件。无菌室的推荐温度为20℃,相对湿度为40%~60%。
1.1.7缓冲间及操作室内均应设置能达到空气消毒效果的紫外灯或其他适宜的消毒装置。
1.2无菌室的管理
1.2.1无菌室在使用前和使用后应进行有效的消毒。
1.2.2无菌室的灭菌效果应至少每两周验证一次。
1.2.3应制定清洁、消毒、灭菌、使用和应急处理程序。
1.2.4应记录环境检测结果,并归档保存。
1.2.5不符合规定时应立即停止使用
1.3微生物实验室消毒处理方法
1.3.1无菌室
1.3.1.1紫外线消毒
(1)在室温20℃~25℃时,220V30W紫外灯下方垂直位置1.0m处的253.7nm紫外线辐射强度应70W/cm2,低于此值时应更换,适当数量的紫外灯,确保平均每立方米应不少于1.5W。
(2)紫外线消毒时,无菌室内应保持清洁干燥。
(3)在无人条件下,可采取紫外线消毒,作用时间应30min,室内湿度20%或40%、相对湿度大于60%时,应适当延长照射时间。
(4)用紫外线消毒物品表面时,应使照射表面受到紫外线的直接照射,且应达到足够的照射剂量。
(5)人员在关闭紫外灯至少30min后方可入内作业。
(6)按照GB 15981的规定,评价紫外线的消毒与杀菌效果。
1.3.1.2臭氧消毒
(1)封闭无菌室内,无人条件下,采用20mg/m3浓度的臭氧,作用时间应30min。消毒后室内臭氧浓度0.2mg/m3时方可入内作业。
(2)按照GB/T 18202的规定,检测室内臭氧的浓度。
1.3.1.3无菌室空气灭菌效果验证方法(沉降法)
(1)在消毒处理后与开展检验活动之前期间采样。
(2)取样点的选择应基于人员流量情况和做试验的频率。一般情况下,无菌室面积30m2时,从所设定的条对角线选取3点,即中心1点,两端各距离墙1m处各取1点;无菌室面积30m2时,选取东西北中5点,其中东点、南点、西点、北点均距离墙lm。
1.3.2生产环境卫生指标:
装配与包装车间空气中细菌菌落总数应≤2500CFU/m3
工作台表面细菌菌落总数应≤20CFU/cm2
工人手表面细菌菌落总数应≤300CFU/只手,并不得检出致病菌。
二.样品的准备
食品生产线每两小时取样1次,异常停机时再取一次。每天取样12瓶,然后在12瓶中随机抽取3瓶做微生物检测。
做微生物之前,在缓冲间用75%的酒精对样品外表进行杀菌。之后送到传递窗口处。避免样品对无菌间造成二次污染。
2.1工作台面与工人手表面采样与测试方法
2.1.1样品采集
工作台:将经灭菌的内径为5cm*5cm的灭菌规格板放在被检物体表面,用以浸有灭菌生理盐水的棉签在其内涂抹10次,然后剪去手接触部分棉棒,将棉签放入含10mL灭菌生理盐水的采样管内送检。
工人手:被检人五指并拢,用以浸湿生理盐水的棉签在右手指曲面,从指尖到指端来回涂擦10次,然后剪去手接触部分棉棒,将棉签放入含10mL灭菌生理盐水的采样管内送检。
2.1.2细菌菌落总数检测
将已采集的样品在6h内送实验室,每支采样管充分混匀后取1mL样液,放入灭菌平皿内,倾注营养琼脂培养基,每个样品平行接种两个平皿,置36℃土2℃培养48h,计数平板上细菌菌落数。
2.2空气采样与测试方法
2.2.1样品采集
在动态下进行。
室内面积不超过30m3,在对角线上设里中外三点:里、外点位置距墙1m;室内面积超过30m3,设东西南北中5点,周围4点距墙1m。采样时,将含营养琼脂培养基的平板(真径9cm)置采样点(约桌面高度),打开平皿盖,使平板在空气中暴露5min。
2.2.2细菌培养
在采样前将准备好的营养琼脂培养基置36℃土2℃培养24h,取出检查有无污染,将污染培养基剔除。
将已采集的培养基在6h内送实验室,于36℃土2℃培养48h,观察结果,计数平板上细菌菌落数。
三、培养基与试剂制备的制备和杀菌
3.1试剂的配制
3.1.1无菌生理盐水的配制
用精确到0.01g的电子称称取8.5g微生物检测专用盐,在100mL烧杯中用二次净化水溶解后,转移到1000mL的无色透明的容量瓶并用二次净化水定容到1000mL备用。
3.1.2营养琼脂培养基的配制
称取35g营养琼脂培养基用二次净化水在250mL的烧杯中溶解后,转移到1000mL的无色透明的容量瓶并用二次净化水定容到1000mL。然后用250mL的锥形瓶分装备用。
3.2试剂的分装
3.2.1生理盐水的分装
将配置好的生理盐水用500mL的量筒按照每个锥形瓶装225mL的量进行分装。分装好用乳胶锥形瓶塞塞好锥形瓶,并用牛皮纸将瓶口包扎好。
3.2.2营养琼脂的分装
将配置好的营养琼脂用500mL的锥形瓶装进行分装。分装好用乳胶锥形瓶塞塞好锥形瓶,并用牛皮纸将瓶口包扎好。
3.2.3孟加拉红琼脂的分装
将配置好的营养琼脂用500mL的锥形瓶装进行分装。分装好用乳胶锥形瓶塞塞好锥形瓶,并用牛皮纸将瓶口包扎好。
3.2.4乳糖胆盐肉汤的分装
将配置好的乳糖胆盐用10mL的量管分装在玻璃试管中,试管规格为15*150mm,锥形瓶装进行分装。分装好用乳胶锥形瓶塞塞好锥形瓶,并用牛皮纸将瓶口包扎好。
3.3培养基和试剂灭菌
3.3.1培养基通常应采用高压湿热灭菌法,121℃灭菌15min,特殊培养基按使用者的特殊要求进行灭菌(如含糖培养基,115℃灭菌20min。)
3.3.2部分培养基(如嗜盐琼脂培养基,胆硫乳培养基等),只能煮沸灭菌。
3.3.3对热敏感的培养基或添加物质,应采用膜过滤方法进行过滤除菌。
3.3.4即用型试剂不需灭菌,应参见相关国际标准或供应商使用说明,直接使用。
3.4试剂的杀菌
3.4.1生理盐水的杀菌
将分装完毕的生理盐水,放在杀菌釜内,摆放好。然后关上杀菌釜,打开电源,升温到80℃时,打开放气阀进行放气,带放气阀门喷出大量水蒸气时关上放气阀。升温至121℃开始计时,杀菌30min停止加热,进行自然冷却,待压力回归零时,打开放气阀门进行放气。等待条菌釜内气压全部排净完后打开杀菌釜,将生理盐水取出送往微生物操作间的小窗内。
3.4.2营养琼脂的杀菌
将分装完毕的营养琼脂,放在杀菌釜内,摆放好。然后关上杀菌釜,打开电源,升温到80℃时,打开放气阀进行放气,带放气阀门喷出大量水蒸气时关上放气阀。升温至121℃开始计时,杀菌30min停止加热,进行自然冷却,待压力回归零时,打开放气阀门门进行放气。等待杀菌釜内气压全部排净完后打开杀菌釜,将生理盐水取出送往微生物操作间预处理间的水浴锅,进行保温,水浴锅的温度46土1℃。
3.5培养基的配制
3.5.1孟加拉红琼脂培养基的配制
称取36g营养琼脂用二次净化水在250mL的烧杯中溶解后,转移到1000mL的无色透明的容量瓶并用二次净化水定容到1000mL。然后用250mL的锥形瓶分装备用。
3.5.2乳糖胆盐肉汤的配制
称取36g营养琼脂用二次净化水在250mL的烧杯中溶解后,转移到1000mL的无色透明的容量瓶并用二次净化水定容到1000mL。然后用250mL的锥形瓶分装备用。
3.6培养基的杀菌
3.6.1孟加拉红琼脂的杀菌
将分装完毕的营养琼脂,放在杀菌釜内,摆放好。然后关上杀菌釜,打开电源,升温到80℃时,打开放气阀进行放气,带放气阀门喷出大量水蒸气时关上放气阀。升温至121℃开始计时,杀菌30min停止加热,进行自然冷却,待压力回归零时,打开放气阀门进行放气。等待杀菌釜内气压全部排净完后打开杀菌釜,将生理盐水取出送往微生物操作间预处理间的水浴锅,进行保温,水浴锅的温度46℃士1℃。
3.6.2乳糖胆盐肉汤的杀菌
将分装完毕的乳糖胆盐发酵管,放在杀菌釜内,摆放好。然后关上杀菌金,打开电源,升温到80℃时,打开放气阀进行放气,带放气阀门喷出大量水蒸气时关上放气阀。升温至121℃开始计时,杀菌30min停止加热,进行自然冷却,待压力回归零时,打开放气阀门进行放气。等待杀菌釜内气压全部排净完后打开杀菌釜,将生理盐水取出送往微生物操作间的小窗内。
3.7培养皿和吸量管的杀菌
培养皿将培养基处理完,用84消毒液浸泡30min后,用洗洁精清洗干净后用干燥箱烘干(160℃、30min)后,用牛皮包扎好,在160℃干热杀菌2小时。1mL的吸量管也用84消毒液浸泡30min后,用洗洁精清洗干净后用干燥箱烘干(160℃、30min)后,用牛皮纸包扎好,在160℃干热杀菌2小时。
3.8器具和设备灭菌
3.8.1湿热灭菌:采用高压灭菌器,121℃灭菌20min,适用于玻璃器皿、移液器吸头、塑料瓶等按照GB 15981的规定,评价高压灭菌器的杀菌效果。
3.8.2干热灭菌:采用干燥箱灭菌,160℃灭菌2h,180℃灭菌1h,适用于玻璃器皿,不锈钢器具等。
3.8.3液体消毒剂消毒:使用适当浓度的自配或商业液体消毒剂对工作台面、器具或设备表面进行消毒。可按照GB 15981的规定,评价自配或商业消毒剂的消毒效果;可按照ISO 18593,监测工作台面、器具或设备表面的消毒效果。
3.9培养基常见问题
3.9.1培养基不能凝固的原因
制备过程中过度加热;
低pH值造成培养基酸解;
称量不正确;
琼脂未完全溶解;
培养基成分未充分混匀。
3.9.2培养基pH值不正确的原因
制备过程中过度加热;
水质不佳;
外部化学物质污染;
测定pH值时温度不正确;
pH计未正确校准;
脱水培养基质量差。
3.9.3培养基产生沉淀的原因
制备过程中过度加热;
水质不佳;
脱水培养基质量差;
pH未正确控制。
3.9.4培养基颜色异常的原因
制备过程中过度加热;
水质不佳;
脱水培养基质量差;
pH不正确;
外来污染。
3.9.5培养基出现抑制重复性差
制备过程中过度加热;
水质不佳;
脱水培养基质量差;
使用成分不正确,如:成分称量不准,添加物浓度不正确。
3.9.6培养基选择性差的原因
制备过程中过度加热;
脱水培养基质量差;
配方使用不对;
添加成分不正确,如加入添加成分时培养
基过热或添加浓度错误。
四、微生物实验操作
4.1实验前准备
4.1.1无菌操作台和微生物操作间杀菌消毒。
每次做实验之前,用75%的酒精对无菌操作台和微生物操作间进行喷洒消毒,然后开启无菌操作台上面的紫外灯对无菌操作台杀菌30min以上。同时,开启微生物操作间紫外灯对空气杀菌消毒30min以上。
4.1.2微生物检验人员的工作服、帽、口罩和鞋子的杀菌。微生物检验人员的工作服、帽、口罩和鞋子在实验之前,在微生物操作缓冲间用紫外灯杀菌30min以上。操作人员在进入微生物操作间时,先用香皂清洗手,然后用消毒好的毛巾擦干手,再用75%的酒精对手进行喷洒杀菌。
4.1.3营养琼脂和孟加拉红培养基外表面的杀菌。
营养琼脂培养基在拿进微生物操作间时,先用75%的酒精喷酒消毒,因为锥形瓶外表面容易长菌,同时在打开锥形瓶塞是用酒精灯对瓶塞外表烤边进行杀菌。微生物操作时,倒平板时,培养皿应该靠近酒精灯,同时每次对锥形瓶口烤下。
4.1.4乳糖胆盐发酵口和样品的口杀菌。
五、实验室废弃物处理
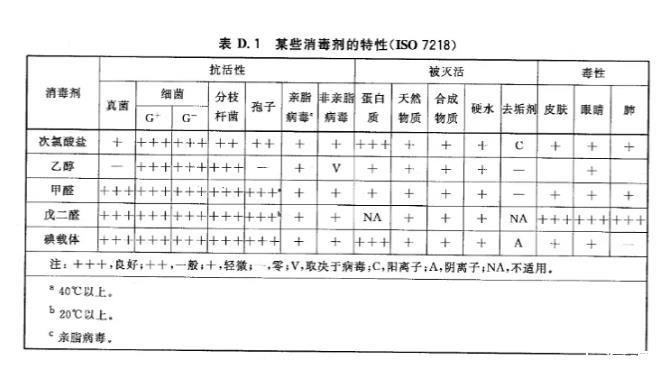
5.1对于培养物及其污染的物品(如斜面,用过的吸量管、细菌培养皿等),应使用适当浓度的自配或商业液体消毒剂(参照D.1)对处理后一定时间,或121℃高压灭菌至少30min,或者其他有效处理措施。将处理物倒入特殊标识的垃圾袋内,直接送到指定地点。
5.2对于实验动物尸体及相关废弃物,按照GB 14925的规定进行处理。
5.3记录并保留废弃物和处理的记录。
六、实验结果报告
6.1菌落总数的计数
可用肉眼观察,必要时用放大镜,记录稀释倍数和相应的菌落数量。
选取南落数在30CF∪到300CFU之间、无基延菌落生长的平板计数菌落总数,低于30CFU平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数:若状菌落不到平板的一半,而其余一半菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。
6.2菌落总数的计算方法
若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(mL)样品中菌落总数的结果。
若有两个连续稀释度的平板菌落数在适宜计数范围内,按公式计算。
若所有稀释度的平板上菌落数大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
若所有稀释度的平板上菌落数小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
若所有稀释度的平板上菌落数均不在30CFU300CFU之间,其中一部分小于30CFU或大于300CFU,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
6.3菌落总数的报告
菌落数小于100CFU时,按照“四舍五入”原则修约,以整数报告。
菌落数大于或等于100CFU时,第3位数字采用“四舍五入”原则修约:取前2位数字,后面用0代替位数:也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。
若空白对照上有菌落生长,则此次检测结果无效。
6.4霉菌和醇母菌计数
可用肉眼观察,必要时用放大镜,记录稀释倍数和相应的菌落数量。
选取菌落数在10CFU到150CFU的平板、根据菌落形态分别计数霉菌和醉母数。霉菌蔓延生长覆盖整个平板的可记录为多不可数。菌落数应采用两个平板的平均数。
6.5霉菌和醇母菌菌落总数的计算方法
计算两个平板菌落数的平均值,再将平均值乘以相应稀释信数计算。
若所有稀释度的平板上菌落数均大于300CFU则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
若所有稀释度的平板上菌落数小于10CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
若所有稀释度(包括液休样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算:如为原液,则以小于1计数。
6.6霉菌和酵母菌菌落总数的报告
菌落数在100以内时,按“四舍五入”原则修约,采用两位有效数字报告。
菌落数大于或等于100CFU时,第3位数字采用“四舍五入”原则修约:取前2位数字,后面用0代替位数也可用10的指数形式来表示,按“四舍五入”原则可。采用两位有效数字。
七、设备的校准、维护和性能验证
7.1总则
7.1.1设备操作要求
实验室负责人应确保每位操作人员均能按照说明书或设备操作指导书的要求进行操作。
7.1.2设备手册
所有设备档案应按照易于检索的方式存档。包括设备手册,使用说明书、维修保养指南:购买时所附带的全部技术资料以及采购、验收的记录。还应该搜集设备使用记录、维修保养记录等。
7.1.3设备记录
7.1.3.1应详细记录与预期质量控制结果不一致的情况,附上所采取的纠正措施,由负责分析的人员验证并通知实验室负责人。实验室负责人应定期审核这些记录。
7.1.3.2每台对检测质量有影响的设备应有使用记录本并放在设备附近。
7.1.3.3有关设备的每个事件都应记录在案,包括日期、事件、采取的纠正措施、登记人的姓名等。
7.1.3.4应保存所有设备最近三年的使用记录本和维护记录本。
7.2设备的校准
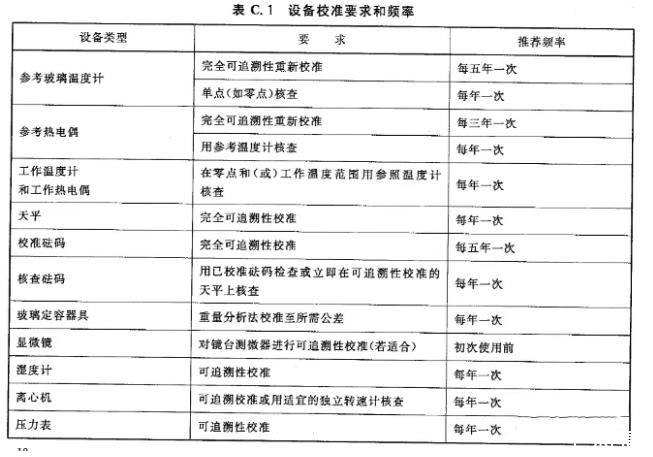
应根据需要、设备类型和以往的性能情况和相应的法规要求确定校准频率(见表C.1)
7.2.1设备校准要求和频率
7.2.2设备性能验证要求和频率
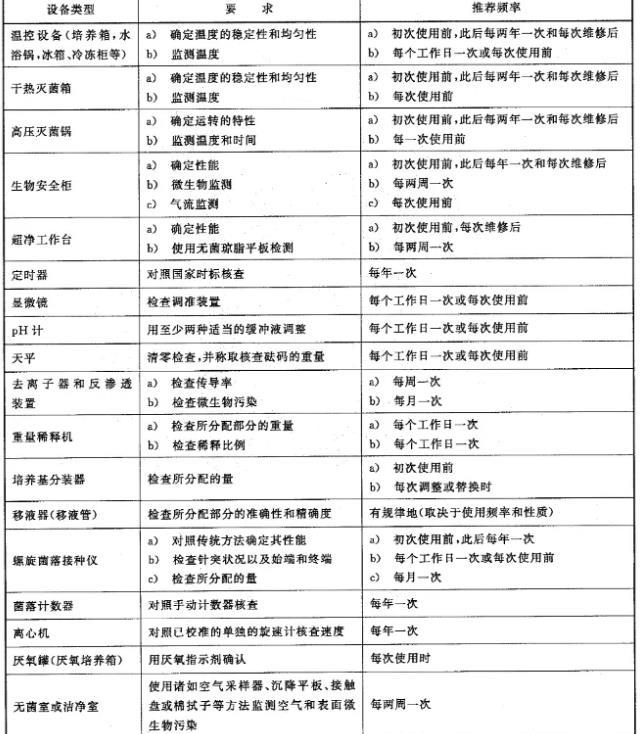
7.2.3设备维护、清洁的要求和频率

相关新闻推荐
1、不同氮源、无机盐、ph、温度对多形炭角菌生长的影响(一)
